Nitrato de prata (AgNO3) é um composto químico composto de prata, nitrogênio e oxigênio. É comumente usado em fotografia, medicina e como reagente de laboratório para diversas reações.
| Nome IUPAC | Nitrato de prata |
| Fórmula molecular | AgNO3 |
| Número CAS | 7761-88-8 |
| Sinônimos | Mononitrato de prata, sal de prata (1+) de ácido nítrico, nitrato de prata (I) |
| InChI | InChI=1S/Ag.NO3/c;2-1(3)4/q+1;-1 |
Propriedades do nitrato de prata
Fórmula de nitrato de prata
A fórmula do mononitrato de prata é AgNO3. Consiste em um átomo de prata (Ag), um átomo de nitrogênio (N) e três átomos de oxigênio (O). A fórmula representa a proporção de átomos em uma molécula de mononitrato de prata.
Massa molar de nitrato de prata
A massa molar do mononitrato de prata é calculada somando as massas atômicas de seus elementos constituintes. A prata tem massa atômica de 107,87 g/mol, o nitrogênio tem massa de 14,01 g/mol e cada átomo de oxigênio tem massa de 16,00 g/mol. A sua adição dá uma massa molar de aproximadamente 169,87 g/mol para o mononitrato de prata.
Ponto de ebulição do nitrato de prata
O mononitrato de prata tem um ponto de ebulição de cerca de 440 graus Celsius (824 graus Fahrenheit). A esta temperatura, o composto sofre uma transição de fase do estado líquido para o estado gasoso. O ponto de ebulição indica a temperatura na qual a pressão de vapor da substância se iguala à pressão atmosférica.
Ponto de fusão do nitrato de prata
O ponto de fusão do mononitrato de prata é de aproximadamente 209 graus Celsius (408 graus Fahrenheit). Esta é a temperatura na qual a forma sólida do mononitrato de prata se transforma em líquido. O ponto de fusão é uma propriedade característica de uma substância e ajuda a determinar seu comportamento físico sob diferentes condições.
Densidade de nitrato de prata g/mL
A densidade do mononitrato de prata é de aproximadamente 4,35 g/mL. A densidade é uma medida da quantidade de massa contida em um determinado volume. É calculado dividindo a massa de uma substância pelo seu volume. A densidade do mononitrato de prata indica quão compacto ele é ou quão concentrado está em um espaço específico.
Peso molecular do nitrato de prata
O peso molecular do mononitrato de prata, também chamado de massa molar, é de aproximadamente 169,87 g/mol. Representa a soma das massas atômicas de todos os átomos de uma molécula de mononitrato de prata. O peso molecular é usado em vários cálculos e conversões envolvendo quantidades do composto.
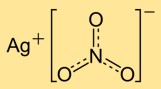
Estrutura do nitrato de prata
O mononitrato de prata possui uma estrutura cristalina composta por cátions de prata (Ag+) e ânions nitrato (NO3-). Os íons de prata são rodeados por íons nitrato, formando uma rede regular. Esta estrutura iônica contribui para a estabilidade e propriedades do composto.
Solubilidade do nitrato de prata
O mononitrato de prata é muito solúvel em água. Dissolve-se facilmente em água para formar uma solução límpida e incolor. A solubilidade do mononitrato de prata em água é uma característica essencial e desempenha um papel crucial em diversas aplicações, como na medicina, fotografia e reações químicas.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 4,35g/ml |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 169,87 g/mol |
| Densidade | 4,35g/ml |
| Ponto de fusão | 209°C (408°F) |
| Ponto de ebulição | 440°C (824°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Solúvel |
| Solubilidade | Solúvel em água e solventes orgânicos como etanol |
| Pressão de vapor | 0,26 mmHg a 25°C (77°F) |
| Densidade do vapor | Não aplicável |
| pKa | – |
| pH | Ácido (aproximadamente pH 5-6 em solução aquosa) |
Segurança e perigos do nitrato de prata
O mononitrato de prata apresenta alguns riscos de segurança e deve-se tomar cuidado ao manusear o composto. É considerado prejudicial se ingerido, inalado ou se entrar em contato com a pele ou os olhos. Devem ser utilizadas medidas de proteção como luvas, óculos de segurança e jalecos. Isto pode causar irritação, queimaduras e manchas na pele e outras superfícies. Quando aquecido, pode liberar óxidos de nitrogênio tóxicos. Deve ser armazenado em local fresco e seco, longe de substâncias incompatíveis. Os derramamentos devem ser limpos imediatamente e o descarte de resíduos deve seguir diretrizes apropriadas para evitar a contaminação do meio ambiente.
| Símbolos de perigo | Corrosivo, Oxidante |
| Descrição de segurança | Causa queimaduras na pele e lesões oculares graves. |
| Identificadores das Nações Unidas | ONU 1493 (mononitrato de prata sólida) |
| Código SH | 2843.10.00 |
| Classe de perigo | Classe 5.1 (Materiais oxidantes) |
| Grupo de embalagem | GE II (intermediário) |
| Toxicidade | Tóxico para a vida aquática com efeitos a longo prazo. |
Métodos de síntese de nitrato de prata
Existem diferentes métodos para sintetizar mononitrato de prata.
Um método comum envolve a reação entre prata metálica e ácido nítrico . Neste processo, o ácido nítrico diluído dissolve a prata para produzir mononitrato de prata. Outro método envolve a reação de óxido de prata ou carbonato de prata com ácido nítrico, resultando na formação de mononitrato de prata.
Além disso, a reação entre o cloreto de prata e o ácido nítrico também pode produzir mononitrato de prata. O ácido nítrico dissolve o cloreto de prata, deslocando os íons cloreto e formando mononitrato de prata.
Além disso, a reação do sulfato de prata com um sal nitrato solúvel, como o nitrato de sódio, permite a aquisição do mononitrato de prata. O sulfato de prata reage com o sal nitrato em solução aquosa, levando à formação de mononitrato de prata e um sal sulfato solúvel.
Ao implementar estes métodos sintéticos, é importante tomar precauções de segurança adequadas e utilizar ácidos corrosivos e compostos potencialmente tóxicos. Os protocolos e diretrizes laboratoriais também devem ser seguidos para garantir a preparação e o manuseio precisos do mononitrato de prata.
Usos do nitrato de prata
O mononitrato de prata tem muitos usos em diferentes campos. Aqui estão algumas aplicações comuns:
- Fotografia: A fotografia tradicional em preto e branco utiliza mononitrato de prata como um composto sensível à luz que reage com a luz, formando partículas de prata e revelando imagens fotográficas.
- Medicina: As aplicações médicas utilizam mononitrato de prata por suas propriedades anti-sépticas no tratamento de feridas. Sua aplicação tópica previne infecções, estimula a cicatrização e trata queimaduras, úlceras e outras feridas na pele.
- Reagente de Laboratório: O mononitrato de prata serve como um reagente de laboratório versátil, possibilitando diversas reações químicas e sendo utilizado em química analítica para detectar a presença de haletos e outros compostos.
- Chapeamento de prata: Os processos de galvanoplastia usam mononitrato de prata para depositar ativamente uma fina camada de prata em várias superfícies. Esse uso é comum para fins decorativos e para proporcionar resistência à corrosão.
- Coloração e coloração: A histologia e a microscopia usam mononitrato de prata como corante para melhorar ativamente a visibilidade de estruturas específicas em amostras biológicas. A indústria têxtil utiliza-o para tingir tecidos.
- Gravura: A natureza corrosiva do mononitrato de prata permite seu uso ativo na gravação de padrões em vidros e espelhos. Remove seletivamente camadas superficiais, criando padrões complexos.
- Educação Química: As instituições educacionais estão usando ativamente o mononitrato de prata para realizar experimentos e demonstrações químicas, devido às suas reações e efeitos visuais distintos.
- Catalisador de Prata: Em algumas reações químicas, o mononitrato de prata atua ativamente como catalisador, facilitando a conversão dos reagentes nos produtos desejados.
Questões:
P: O AgNO3 é solúvel em água?
R: Sim, AgNO3 é solúvel em água.
P: O que é AgNO3?
R: AgNO3 é mononitrato de prata, um composto químico composto de prata, nitrogênio e oxigênio.
P: Quais são os íons espectadores na reação entre KCl(aq) e AgNO3(aq)?
R: Na reação entre KCl(aq) e AgNO3(aq), os íons espectadores são K+ e NO3-.
P: Quais íons, se houver, são íons espectadores na reação AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)?
R: Na reação AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq), os íons espectadores são Na+ e NO3-.
P: Quantos moles de Cu são necessários para reagir com 5,8 moles de AgNO3?
R: A equação balanceada é necessária para determinar o número de moles de Cu necessários para reagir com 5,8 moles de AgNO3.
P: Qual dos seguintes compostos produzirá um precipitado com AgNO3?
R: Compostos contendo íons Cl-, Br- ou I- produzirão um precipitado com AgNO3.
P: AgNO3 é um composto iônico?
R: Sim, AgNO3 é um composto iônico.
P: O AgNO3 é um eletrólito forte?
R: Sim, AgNO3 é um eletrólito poderoso.
P: O AgNO3 conduz eletricidade?
R: Sim, o AgNO3 conduz eletricidade quando dissolvido em água.
P: O nitrato de prata é um sal?
R: Sim, o mononitrato de prata é um sal.
P: Posso comprar nitrato de prata?
R: Sim, o mononitrato de prata está disponível comercialmente para compra.
P: O nitrato de prata é uma solução?
R: O mononitrato de prata pode existir na forma sólida ou em solução, dependendo de sua condição.
P: Como remover manchas de nitrato de prata?
R: As manchas de mononitrato de prata podem ser removidas tratando a área afetada com um agente redutor suave, como peróxido de hidrogênio ou tiossulfato de sódio.
P: O nitrato de prata é solúvel em água?
R: Sim, o mononitrato de prata é solúvel em água.
P: Que precipitado se forma quando soluções de nitrato de prata e cromato de potássio são misturadas?
R: Quando soluções de mononitrato de prata e cromato de potássio são misturadas, forma-se um precipitado amarelo de cromato de prata (Ag2CrO4).
P: Qual é a massa molar do nitrato de prata?
R: A massa molar do mononitrato de prata (AgNO3) é de aproximadamente 169,87 g/mol.
Q: Prata metálica é adicionada a uma solução de nitrato de chumbo (II). Qual é a reação química balanceada?
R: A reação química balanceada é 2Ag + Pb(NO3)2 → 2AgNO3 + Pb.
