Nitrato de níquel (Ni(NO₃)₂) é um composto químico que contém íons de níquel e nitrato. É solúvel em água e frequentemente utilizado em catalisadores, galvanoplastia e como precursor de outros compostos de níquel.
| Nome IUPAC | Dinitrato de Níquel |
| Fórmula molecular | Ni(NO₃)₂ |
| Número CAS | 13138-45-9 |
| Sinônimos | Nitrato de níquel (II), nitrato de níquel, dinitronickel, bis(nitrato) de níquel |
| InChI | InChI=1S/2NO3.Ni/c2 2-1(3)4;/q2 -1;+2 |
Propriedades do nitrato de níquel
Fórmula de nitrato de níquel
A fórmula química do dinitrato de níquel é Ni(NO₃)₂. Representa um composto composto por cátions de níquel (Ni) e ânions nitrato (NO₃). O subscrito “2” na fórmula indica que existem dois íons NO3- para cada cátion Ni+2.
Massa molar de nitrato de níquel
A massa molar do dinitrato de níquel pode ser calculada somando as massas atômicas de seus elementos constituintes. O níquel (Ni) tem massa molar de aproximadamente 58,69 g/mol, enquanto o nitrato (NO₃) tem massa molar de aproximadamente 62,00 g/mol. Somando-os, a massa molar do dinitrato de níquel é de aproximadamente 182,69 g/mol.
Ponto de ebulição do nitrato de níquel
O ponto de ebulição do dinitrato de níquel refere-se à temperatura na qual ele muda de líquido para gás. O ponto de ebulição do dinitrato de níquel é de aproximadamente 136,7 graus Celsius (278,06 graus Fahrenheit). Porém, é fundamental observar que este valor pode variar ligeiramente dependendo da pureza do composto.
Ponto de fusão do nitrato de níquel
O ponto de fusão do dinitrato de níquel é a temperatura na qual ele muda do estado sólido para o líquido. O ponto de fusão do dinitrato de níquel é de aproximadamente 56,7 graus Celsius (134,06 graus Fahrenheit). Tal como o ponto de ebulição, o ponto de fusão pode ser influenciado pela pureza do composto.
Densidade de nitrato de níquel g/mL
A densidade do dinitrato de níquel é uma medida de sua massa por unidade de volume. O dinitrato de níquel tem uma densidade de aproximadamente 1,68 g/mL. Este valor indica que é mais denso que a água, que tem densidade de 1 g/mL.
Peso molecular do nitrato de níquel
O peso molecular do dinitrato de níquel é a soma dos pesos atômicos de todos os átomos presentes em sua fórmula química. Como mencionado anteriormente, o peso molecular do dinitrato de níquel é de aproximadamente 182,69 g/mol.
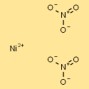
Estrutura do nitrato de níquel
A estrutura do dinitrato de níquel pode ser visualizada como cátions de níquel (Ni²⁺) rodeados por dois ânions nitrato (NO₃⁻) por cátion. Os íons nitrato formam ligações coordenadas com cátions de níquel, criando um composto iônico estável.
Solubilidade do nitrato de níquel
O dinitrato de níquel é muito solúvel em água e forma uma solução límpida azul esverdeada. Sua solubilidade em água é uma propriedade essencial, pois permite que seja facilmente utilizado em diversas aplicações, como catalisadores, galvanoplastia e produção de outros compostos de níquel.
| Aparência | Sólido azul esverdeado |
| Gravidade Específica | 1,68 g/ml |
| Cor | azul-esverdeado |
| Cheiro | Inodoro |
| Massa molar | 182,69 g/mol |
| Densidade | 1,68 g/ml |
| Ponto de fusão | 56,7ºC |
| Ponto de ebulição | 136,7°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel |
| Solubilidade | Solúvel em água e solventes orgânicos como etanol |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | Não disponível |
| pH | Neutro (cerca de 7) |
Observe que algumas propriedades podem não estar disponíveis ou não ser relevantes para o diitrato de níquel.
Segurança e perigos do nitrato de níquel
O dinitrato de níquel apresenta alguns riscos de segurança e deve-se tomar cuidado ao manuseá-lo. O contato direto com o composto pode causar irritação na pele e nos olhos. A inalação de poeira ou vapores pode causar irritação respiratória. É essencial usar equipamentos de proteção adequados, como luvas e óculos de segurança, ao trabalhar com dinitrato de níquel. Evite a ingestão, pois pode ser prejudicial à saúde. Em caso de exposição acidental, procure imediatamente atendimento médico. Além disso, o armazenamento adequado numa área bem ventilada, longe de substâncias incompatíveis, é crucial para minimizar riscos potenciais e garantir um manuseamento seguro.
| Símbolos de perigo | Corrosivo, Irritante, Perigoso para a saúde |
| Descrição de segurança | Causa irritação na pele e nos olhos. Nocivo se inalado ou engolido. Manuseie com cuidado. Evite contato direto. Use equipamento de proteção. |
| Números de identificação da ONU | UN2724 |
| Código SH | 2834.2990 |
| Classe de perigo | 5.1 (Substâncias oxidantes) |
| Grupo de embalagem | II |
| Toxicidade | Moderadamente tóxico |
Métodos para a síntese de nitrato de níquel
Existem vários métodos para sintetizar dinitrato de níquel. Um método comum envolve a reação entre óxido de níquel (NiO) ou hidróxido de níquel (Ni(OH)₂) com ácido nítrico (HNO₃). Durante este processo, o óxido de níquel ou hidróxido de níquel se dissolve em ácido nítrico, levando à formação de dinitrato de níquel e água como subprodutos.
A reação pode assumir a seguinte representação:
- Com óxido de níquel: NiO + 2HNO₃ → Ni(NO₃)₂ + H₂O
- Com hidróxido de níquel: Ni(OH)₂ + 2HNO₃ → Ni(NO₃)₂ + 2H₂O
Outra abordagem envolve a reação entre o níquel metálico e o ácido nítrico concentrado, que resulta na formação de dinitrato de níquel e gás dióxido de nitrogênio (NO₂) como subproduto:
- Com Níquel Metal: Ni + 4HNO₃ → Ni(NO₃)₂ + 2H₂O + 2NO₂
É importante realizar estas reações sob condições bem controladas porque o ácido nítrico é um forte agente oxidante e pode ser perigoso. Garanta um resultado seguro e bem-sucedido durante o processo de síntese, empregando ativamente medidas e equipamentos de segurança apropriados. Além disso, a escolha dos reagentes e das condições de reação pode variar dependendo da aplicação específica e das propriedades desejadas do produto dinitrato de níquel.
Usos do nitrato de níquel
O dinitrato de níquel encontra múltiplas aplicações em diversos setores devido às suas propriedades únicas. Aqui estão alguns de seus principais usos:
- Galvanoplastia: O dinitrato de níquel permite a deposição de uma fina camada de níquel sobre diversos metais, melhorando sua resistência à corrosão e aparência durante os processos de galvanoplastia.
- Catalisador: Desempenha papel crucial como catalisador em reações químicas, facilitando a conversão de reagentes em produtos desejados, principalmente em síntese orgânica.
- Cerâmica: A indústria cerâmica utiliza dinitrato de níquel para conferir coloração específica e melhorar o desempenho dos materiais cerâmicos.
- Indústria do vidro: Os fabricantes da indústria do vidro usam dinitrato de níquel para produzir vidro colorido com propriedades ópticas desejáveis.
- Produção de baterias: Os fabricantes usam dinitrato de níquel na produção de baterias à base de níquel, incluindo baterias de níquel-hidreto metálico (NiMH).
- Células a combustível: O dinitrato de níquel atua como precursor na fabricação de eletrodos de óxido de níquel para células a combustível de óxido sólido (SOFCs).
- Pirotecnia: Na pirotecnia, o dinitrato de níquel atua como oxidante, produzindo chamas verdes em fogos de artifício.
- Reagentes Químicos: Funciona como reagente em diversas reações químicas, principalmente aquelas que envolvem complexos de níquel.
- Fertilizantes: Na agricultura, o dinitrato de níquel é ocasionalmente usado como fonte de níquel em fertilizantes para suprir deficiências de níquel em certas culturas.
As diversas aplicações do dinitrato de níquel em diferentes indústrias destacam sua importância como um composto versátil com ampla variedade de utilizações práticas.
Questões:
P: Quando soluções de fosfato de amônio e nitrato de níquel (ii) são misturadas, o que precipita?
A: Precipitados de fosfato de níquel (II).
P: Qual é a molaridade de uma solução contendo 5,8 gramas de nitrato de níquel em 500 ml?
R: A molaridade é 0,2 M.
P: Quais comprimentos de onda o nitrato de níquel absorve?
R: O dinitrato de níquel absorve comprimentos de onda nas regiões ultravioleta e visível.
P: O nitrato de níquel II é solúvel?
R: Sim, o dinitrato de níquel (II) é solúvel em água.
P: Qual é a fórmula do nitrato de níquel II?
R: A fórmula é Ni(NO₃)₂.
P: Qual é a cor do nitrato de níquel II?
R: A cor do dinitrato de níquel (II) é azul esverdeado.
P: Quantos átomos de nitrogênio existem na fórmula química Ni(NO₃)₂?
R: Existem quatro átomos de nitrogênio.
P: O Ni(NO₃)₂ é solúvel em água?
R: Sim, Ni(NO₃)₂ é solúvel em água.
P: Qual dos compostos C4H10, BaCl2, Ni(NO₃)₂, SF6 deveria existir como unidades de fórmula?
R: C4H10 (butano) e SF6 (hexafluoreto de enxofre) devem existir como unidades de fórmula. BaCl2 e Ni(NO₃)₂ são compostos iônicos.
