O nitrato de lítio (LiNO₃) é um composto químico usado em diversas aplicações. Apresenta propriedades únicas, como sua solubilidade em água e seu papel na produção de cerâmica e vidro.
| Nome IUPAC | Nitrato de lítio |
| Fórmula molecular | LiNO₃ |
| Número CAS | 7790-69-4 |
| Sinônimos | Nitrato de lítio, sal de lítio de ácido nítrico, nitrato de lítio (I) |
| InChi | InChI=1S/Li.NO3/c;2-1(3)4/q+1;-1 |
Propriedades do nitrato de lítio
Fórmula de nitrato de lítio
A fórmula do sal de lítio do ácido nítrico é LiNO₃. Consiste em um átomo de lítio (Li), um átomo de nitrogênio (N) e três átomos de oxigênio (O). Esta fórmula química representa a composição de cada elemento do composto.
Massa molar de nitrato de lítio
O sal de lítio do ácido nítrico tem uma massa molar de aproximadamente 68,95 g/mol. A massa molar refere-se à massa de um mol de uma substância e é calculada somando as massas atômicas de todos os átomos da fórmula.
Ponto de ebulição do nitrato de lítio
O sal de lítio do ácido nítrico tem um ponto de ebulição de cerca de 600°C (1112°F). Ponto de ebulição é a temperatura na qual uma substância passa de líquido para gás sob pressão atmosférica padrão.
Ponto de fusão do nitrato de lítio
O sal de lítio do ácido nítrico tem um ponto de fusão de cerca de 255°C (491°F). O ponto de fusão é a temperatura na qual uma substância muda de sólido para líquido sob pressão atmosférica padrão.
Densidade de nitrato de lítio g/mL
A densidade do sal de lítio do ácido nítrico é de aproximadamente 2,38 g/mL. A densidade representa a massa de uma substância por unidade de volume e é uma propriedade importante para a compreensão de seu comportamento físico.
Peso molecular de nitrato de lítio
O peso molecular do sal de lítio do ácido nítrico é 68,95 g/mol. O peso molecular é a soma dos pesos atômicos de todos os átomos de uma molécula e é expresso em gramas por mol.
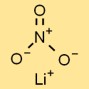
Estrutura do nitrato de lítio
O sal de lítio do ácido nítrico tem uma estrutura cristalina iônica, onde cátions de lítio (Li⁺) e ânions nitrato (NO₃⁻) formam um padrão de repetição regular. Esta estrutura contribui para a sua estabilidade e propriedades características.
Solubilidade do nitrato de lítio
O sal de lítio do ácido nítrico é altamente solúvel em água. Essa alta solubilidade é uma de suas características essenciais e o torna útil em diversas aplicações, como na produção de cerâmica e vidro.
| Aparência | Sólido branco |
| Gravidade Específica | N / D |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 68,95 g/mol |
| Densidade | 2,38 g/ml |
| Ponto de fusão | 255°C (491°F) |
| Ponto de ebulição | 600°C (1112°F) |
| Ponto flash | N / D |
| Solubilidade em Água | Muito solúvel |
| Solubilidade | Solúvel em água e solventes orgânicos como etanol |
| Pressão de vapor | N / D |
| Densidade do vapor | N / D |
| pKa | N / D |
| pH | N / D |
Observe que algumas propriedades podem não ser aplicáveis (N/A) ou ter dados limitados disponíveis para nitrato de lítio.
Segurança e perigos do nitrato de lítio
O sal de lítio do ácido nítrico apresenta certas considerações de segurança e perigo. Pode ser irritante para a pele, olhos e trato respiratório por contato ou inalação. Ao manusear é essencial usar equipamentos de proteção adequados, como luvas e óculos de segurança. Evite a ingestão, pois pode causar desconforto gastrointestinal. Armazene-o longe de substâncias incompatíveis para evitar reações perigosas. Se ocorrerem derramamentos ou vazamentos, contenha-os e limpe-os imediatamente. Além disso, siga sempre as orientações adequadas de armazenamento e mantenha-o em uma área segura e bem ventilada. Priorize práticas de manuseio seguras e siga os protocolos de segurança relevantes para minimizar os riscos associados ao sal de lítio do ácido nítrico.
| Símbolos de perigo | Aviso |
| Descrição de segurança | – Irritante para a pele, olhos e trato respiratório. – Evite a ingestão. – Utilize equipamento de proteção. – Armazenar em local bem ventilado. |
| Números de identificação da ONU | UN1477 |
| Código SH | 28342990 |
| Classe de perigo | 5.1 (Agente oxidante) |
| Grupo de embalagem | II |
| Toxicidade | Baixa toxicidade, mas deve ser manuseado com cuidado e medidas de segurança adequadas. |
Observe que os símbolos de perigo específicos e as recomendações de segurança podem variar dependendo da jurisdição e dos regulamentos. Consulte sempre as fichas de dados de segurança apropriadas e as diretrizes de segurança locais ao manusear sal de lítio de ácido nítrico.
Métodos de síntese de nitrato de lítio
Existem vários métodos para sintetizar o sal de lítio do ácido nítrico.
Uma abordagem comum envolve a reação entre carbonato de lítio (Li₂CO₃) e ácido nítrico (HNO₃) . Durante este processo, os dois compostos reagem para produzir sal de lítio de ácido nítrico e água (H₂O) como subprodutos. A equação química para esta reação é:
Li₂CO₃ + 2HNO₃ → 2LiNO₃ + H₂O
Outro método é reagir o hidróxido de lítio (LiOH) com ácido nítrico para obter sal de lítio de ácido nítrico e água. A equação da reação é:
LiOH + HNO₃ → LiNO₃ + H₂O
O sal de lítio do ácido nítrico é formado pela neutralização do ácido nítrico com óxido de lítio (Li₂O) ou carbonato de lítio. As equações são:
Li₂O + 2HNO₃ → 2LiNO₃ + H₂O Li₂CO₃ + 2HNO₃ → 2LiNO₃ + CO₂ + H₂O
Em todos estes métodos, é importante manusear os reagentes e produtos com cuidado devido à sua reatividade e perigos potenciais. Medidas de segurança adequadas e condições controladas são essenciais durante o processo de síntese para garantir a produção bem-sucedida do sal de lítio do ácido nítrico.
Usos do nitrato de lítio
O sal de lítio do ácido nítrico encontra diversas aplicações devido às suas propriedades únicas. Aqui estão seus usos:
- Tratamento de ar: O sal de lítio do ácido nítrico atua como dessecante em aplicações de tratamento de ar, removendo a umidade do ar para evitar a corrosão e manter condições ambientais ideais.
- Reagentes em síntese química: Serve como fonte de íons nitrato em diversas reações químicas, sendo útil na síntese de outros compostos e substâncias.
- Produtos químicos especiais: Encontram aplicações na produção de produtos químicos especiais, incluindo catalisadores e inibidores de corrosão.
- Pirotecnia e fogos de artifício: O sal de lítio do ácido nítrico desempenha um papel crucial como oxidante na pirotecnia, contribuindo para a cor vermelha brilhante vista nos fogos de artifício.
- Indústria farmacêutica: A indústria farmacêutica utiliza sal de lítio do ácido nítrico como reagente em síntese química e pesquisa para determinadas formulações farmacêuticas.
- Baterias de lítio: Embora não seja usado diretamente em baterias, o sal de lítio do ácido nítrico é relevante para a indústria de baterias de íons de lítio. Os fabricantes incorporam sais de lítio derivados do sal de lítio do ácido nítrico nos eletrólitos usados nessas baterias.
- Reatores nucleares: Alguns tipos de reatores nucleares usam sal de lítio de ácido nítrico como refrigerante devido às suas propriedades de absorção de nêutrons.
- Produção de cerâmica e vidro: Nos processos de fabricação de cerâmica e vidro, o sal de lítio do ácido nítrico atua como agente fundente. Reduz efetivamente o ponto de fusão dos materiais, melhorando assim a sua trabalhabilidade e a qualidade do produto.
- Fluidos de transferência de calor: O sal de lítio do ácido nítrico encontra aplicação em fluidos de transferência de calor, principalmente em sistemas de energia solar, devido à sua alta solubilidade em água. Facilita a troca de calor eficiente e permite o armazenamento de energia térmica.
Questões:
P: Quantos átomos no total existem em uma molécula de nitrato de lítio, LiNO₃?
R: Existem 5 átomos em uma molécula de sal de lítio de ácido nítrico: 1 átomo de lítio (Li), 1 átomo de nitrogênio (N) e 3 átomos de oxigênio (O).
P: Quais são as fórmulas corretas para nitrato de cobre (II) hexa-hidratado e cromato de lítio di-hidratado?
R: As fórmulas corretas são Cu(NO₃)₂·6H₂O para nitrato de cobre (II) hexa-hidratado e Li₂CrO₄·2H₂O para cromato de lítio di-hidratado.
P: Quantos gramas de nitrato de lítio serão necessários para preparar 250 ml de uma solução 0,5 M?
R: Você precisará de 17,24 gramas de sal de lítio de ácido nítrico para preparar 250 ml de uma solução 0,5 M.
P: O nitrato de lítio é iônico ou covalente?
R: O sal de lítio do ácido nítrico é um composto iônico.
P: O LiNO₃ é solúvel em água?
R: Sim, o nitrato de lítio (LiNO₃) é solúvel em água.
P: Qual coeficiente deve aparecer antes do LiNO₃ na equação balanceada?
R: O coeficiente “2” deve aparecer antes do LiNO₃ na equação balanceada.
P: Quantos dos seguintes compostos são solúveis em água? Pb(OH)₂, LiNO₃, NH₄Br, K₂S
R: Três dos compostos são solúveis em água: LiNO₃, NH₄Br e K₂S.
P: O LiNO₃ é solúvel?
R: Sim, o LiNO₃ é solúvel.
P: O LiNO₃ é aquoso ou sólido?
R: O LiNO₃ é aquoso quando dissolvido em água.
P: O LiNO₃ é ácido, básico ou neutro?
R: O sal de lítio do ácido nítrico (LiNO₃) é um composto neutro.
P: Quantos átomos no total existem em uma molécula de nitrato de lítio, LiNO₃?
R: Existem 5 átomos em uma molécula de nitrato de lítio: 1 átomo de lítio (Li), 1 átomo de nitrogênio (N) e 3 átomos de oxigênio (O).
P: O LiNO₃ é iônico ou covalente?
R: LiNO₃ é um composto iônico.
