Nitrato de cobre (Cu(NO3)2) é um composto cristalino azul usado em diversas indústrias. Serve como catalisador, agente oxidante e precursor de materiais de cobre em processos químicos.
| Nome IUPAC | Nitrato de cobre (II) |
| Fórmula molecular | Cu(NO3)2 |
| Número CAS | 3251-23-8 |
| Sinônimos | Nitrato cúprico; Nitrato de cobre; Nitrato de cobre; Ácido nítrico, sal de cobre (2+) |
| InChI | InChI=1S/2NO3.Cu/c2 2-1(3)4;/q2 -1;+2 |
Propriedades do nitrato de cobre
Fórmula de nitrato de cobre
A fórmula química do nitrato cúprico é Cu(NO3)2. Isto indica que cada molécula de nitrato cúprico contém um íon cobre (Cu) e dois íons nitrato (NO3). A presença de íons cobre (II) denota um estado de oxidação +2 do cobre.
Massa molar de nitrato de cobre
A massa molar do nitrato cúprico pode ser calculada somando as massas atômicas de seus elementos constituintes. O cobre (Cu) tem massa molar de aproximadamente 63,55 g/mol, enquanto o nitrato (NO3) tem massa molar de aproximadamente 62,00 g/mol. Portanto, a massa molar do nitrato cúprico é aproximadamente 187,55 g/mol.
Ponto de ebulição do nitrato de cobre
O ponto de ebulição do nitrato cúprico refere-se à temperatura na qual ele muda de líquido para gás sob pressão atmosférica padrão. O ponto de ebulição do nitrato cúprico é geralmente acima de 100°C (212°F). No entanto, é importante notar que o nitrato cúprico geralmente se decompõe antes de atingir o seu ponto de ebulição.
Ponto de fusão do nitrato de cobre
O ponto de fusão do nitrato cúprico é a temperatura na qual ele muda do estado sólido para o estado líquido. O ponto de fusão do nitrato cúprico está geralmente entre 256°C e 260°C (493°F e 500°F). É fundamental manusear esta substância com cuidado para evitar sua decomposição.
Densidade de nitrato de cobre g/mL
A densidade do nitrato cúprico refere-se à sua massa por unidade de volume. A densidade do nitrato cúprico sólido é geralmente em torno de 2,32 g/mL, enquanto a densidade de suas soluções aquosas pode variar dependendo da concentração.
Peso molecular do nitrato de cobre
O peso molecular do nitrato cúprico é a soma dos pesos atômicos de todos os átomos de sua fórmula química. Para Cu(NO3)2, o peso molecular é de aproximadamente 187,55 g/mol.
Estrutura do nitrato de cobre
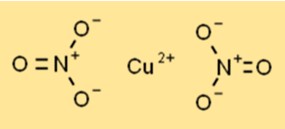
O nitrato cúprico existe como um sólido cristalino azul com uma estrutura cristalina hexagonal. Cada íon cobre (Cu2+) é cercado por seis átomos de oxigênio de dois íons nitrato, criando um arranjo coordenado. A estrutura contribui para sua estabilidade e reatividade em diversos processos químicos.
Solubilidade do nitrato de cobre
O nitrato cúprico é moderadamente solúvel em água. Forma uma solução aquosa quando dissolvido em água, que pode ser utilizada em diversas aplicações como galvanoplastia e como reagente em reações químicas. No entanto, a sua solubilidade diminui com temperaturas mais baixas.
| Aparência | Sólido cristalino azul |
| Gravidade Específica | N / D |
| Cor | Azul |
| Cheiro | Inodoro |
| Massa molar | 187,55 g/mol |
| Densidade | 2,32 g/mL (sólido) |
| Ponto de fusão | 256-260°C (493-500°F) |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | N / D |
| Solubilidade em Água | Moderadamente solúvel, forma uma solução aquosa |
| Solubilidade | Solúvel em água |
| Pressão de vapor | N / D |
| Densidade do vapor | N / D |
| pKa | N / D |
| pH | Ácido |
Segurança e perigos do nitrato de cobre
O nitrato cúprico apresenta certas preocupações de segurança e perigo. É essencial manusear este composto com cautela. O contato direto com a pele ou os olhos pode causar irritação ou queimaduras. A inalação de poeira ou vapores pode causar irritação respiratória. Quando aquecido, pode liberar óxidos de nitrogênio tóxicos. A substância também é um agente oxidante e pode inflamar materiais inflamáveis em contato. Equipamento de proteção adequado, como luvas e óculos de proteção, deve ser usado ao trabalhar com nitrato de cobre. Deve ser armazenado longe de materiais combustíveis e substâncias incompatíveis para minimizar riscos potenciais. Siga sempre as instruções de segurança e use em uma área bem ventilada.
| Símbolos de perigo | Agente oxidante, Corrosivo, Irritante |
| Descrição de segurança | Manuseie com depósito. Evitar o contato com a pele e os olhos. Usar em uma área bem ventilada. Manter afastado de materiais combustíveis. |
| Números de identificação da ONU | UN3085 |
| Código SH | 28342910 |
| Classe de perigo | 5.1 (Agente oxidante) |
| Grupo de embalagem | III |
| Toxicidade | Perigoso se ingerido. Pode causar irritação na pele e nos olhos. A inalação de poeira ou vapores pode causar irritação respiratória. |
Métodos de síntese de nitrato de cobre
Existem vários métodos para sintetizar nitrato cúprico.
Uma abordagem comum envolve a reação entre óxido de cobre (CuO) ou hidróxido de cobre (Cu(OH)2) com ácido nítrico (HNO3) . Ao preparar nitrato cúprico, pode-se adicionar lentamente óxido cúprico ou hidróxido cúprico a uma solução de ácido nítrico, levando à formação de nitrato cúprico e água.
Outro método envolve a reação entre cobre metálico (Cu) e ácido nítrico concentrado. O metal Cu reage com o ácido nítrico para produzir nitrato cúprico, dióxido de nitrogênio (NO2) e água. Este método requer um manuseio cuidadoso devido à formação de gás tóxico dióxido de nitrogênio.
Alternativamente, você pode dissolver cobre metálico ou óxido cúprico em uma mistura de ácido nítrico e peróxido de hidrogênio (H2O2) para produzir nitrato cúprico. Este método permite uma reação mais rápida e produz nitrato de cobre puro.
Finalmente, a reação de duplo deslocamento entre CuSO4 e nitrato de sódio (NaNO3) também pode produzir nitrato cúprico. Ao misturar estes dois sais em água, o nitrato cúprico precipita e o subproduto sulfato de sódio permanece dissolvido.
Siga as precauções de segurança durante a síntese, pois os produtos químicos envolvidos apresentam reatividade. Use equipamento de proteção apropriado e práticas laboratoriais adequadas para garantir uma síntese segura e bem-sucedida de nitrato de cobre.
Usos do nitrato de cobre
O nitrato de cobre encontra diversas aplicações em diferentes indústrias devido às suas propriedades únicas. Alguns usos notáveis incluem:
- Catalisador: Atua como catalisador na síntese orgânica, facilitando reações como a conversão de álcoois em aldeídos ou cetonas.
- Pirotecnia: O nitrato de cobre é um componente chave das formulações pirotécnicas, contribuindo para as cores azul e verde das chamas.
- Agricultura: Na agricultura, serve como fonte de cobre em fertilizantes para fornecer nutrientes essenciais às plantas.
- Agente oxidante: O nitrato de cobre oxida ativamente outras substâncias durante processos químicos.
- Chapeamento de metal: O nitrato de cobre deposita ativamente uma fina camada de Cu em várias superfícies metálicas durante os processos de galvanoplastia.
- Pigmentos e Corantes: O nitrato de cobre contribui ativamente para a criação de pigmentos verdes e azuis para cerâmica, vidro e têxteis.
- Processos fotográficos: o nitrato de cobre contribui ativamente para o desenvolvimento da imagem em determinadas soluções fotográficas.
- Preservação: Encontra aplicação na preservação da madeira auxiliando na fixação de conservantes.
- Preparação de outros compostos de cobre: Serve como precursor para a síntese de diversos materiais e compostos à base de cobre.
A versatilidade e a reatividade do nitrato de cobre tornam-no um produto químico valioso em diversos campos, desde processos industriais até aplicações artísticas.
Questões:
P: O que acontece quando o nitrato de cobre é aquecido?
R: Quando aquecido, o nitrato cúprico se decompõe em óxido cúprico, dióxido de nitrogênio gasoso e oxigênio.
P: O nitrato de cobre é solúvel em água?
R: Sim, o nitrato cúprico é moderadamente solúvel em água.
P: Qual é a fórmula química do nitrato de cobre?
R: A fórmula química do nitrato cúprico é Cu(NO3)2.
P: O nitrato de cobre é um eletrólito forte?
R: Sim, o nitrato cúprico é um eletrólito poderoso, que se dissocia em íons quando dissolvido em água.
P: Qual é a carga do nitrato de cobre?
A: O nitrato de cobre tem uma carga líquida de 0; é um composto neutro.
P: Quantos átomos de nitrogênio existem em 10,2 g de nitrato de cobre (II)?
R: Existem aproximadamente 0,161 moles de nitrato cúprico (II) e, portanto, aproximadamente 0,322 moles de átomos de nitrogênio.
P: Quanta prata pode ser produzida a partir de 3,00 moles de cobre e 3,85 moles de nitrato de prata?
R: Podem ser produzidos 342,3 g de prata, seguindo a equação química balanceada.
P: O nitrato de cobre é solúvel?
R: Sim, o nitrato cúprico é solúvel em água.
P: Qual é a fórmula do nitrato de cobre (II)?
R: A fórmula do nitrato cúprico (II) é Cu (NO3)2.
P: O que a reação de substituição de Cu(NO3)2 e Zn produz?
R: Nitrato de zinco (Zn(NO3)2) e metal cúprico (Cu) são produzidos na reação de substituição.
P: O que é Cu(NO3)2?
R: Cu(NO3)2 é a fórmula química do nitrato cúprico, um composto cristalino azul.
P: Qual dos seguintes é reduzido na seguinte reação? Cu(NO3)2 + Zn -> Zn(NO3)2 + Cu
R: O cobre (Cu) é reduzido durante a reação, ganhando elétrons para formar cobre metálico.
P: Um Cu(OH)2 sólido se forma quando 0,075 g de KOH são dissolvidos em 1,0 L de Cu(NO3)2 1,0 × 10⁻³ M?
R: Não, o Cu(OH)2 sólido não se forma, pois o Cu(NO3)2 ioniza completamente em solução e há um excesso de íons OH⁻ do KOH.
