Nitrato de amônio (NH4NO3) é um composto químico. Pode ser usado como fertilizante ou como explosivo. É altamente solúvel em água e higroscópico.
| Nome da IUPAC | Nitrato de amônio |
| Fórmula molecular | NH4NO3 |
| Número CAS | 6484-52-2 |
| Sinônimos | Sal de amônio de ácido nítrico, Nitrato de amônio (AN), Nitratum de amônio, Nitrame, Nitramon |
| InChI | InChI=1S/NO3.H3N/c2-1(3)4;/h;1H3/q-1;/p+1 |
Propriedades do nitrato de amônio
Fórmula de nitrato de amônio
O nitrato de amônio é um composto químico com a fórmula NH4NO3. É composto por dois íons: amônio (NH4+) e nitrato (NO3-), que são mantidos juntos por uma ligação iônica 2 . É um pó cristalino branco facilmente solúvel em água.
Massa molar de nitrato de amônio
A massa molar do NH4NO3 é 80,043 g/mol. Pode ser calculado somando as massas molares de seus elementos constituintes: nitrogênio, hidrogênio e oxigênio. A massa molar do nitrogênio é 14,0067 g/mol, a massa molar do hidrogênio é 1,00784 g/mol e a massa molar do oxigênio é 15,9999 g/mol.
A massa molar de NH4NO3 = 2 x massa molar de nitrogênio + 4 x massa molar de hidrogênio + 3 x massa molar de oxigênio
A massa molar de NH4NO3 = 28,0134 g/mol + 4,03136 g/mol + 47,9997 g/mol
A massa molar de NH4NO3 = 80,043 g/mol
Ponto de ebulição do nitrato de amônio
NH4NO3 não tem ponto de ebulição definido. Ele se decompõe em altas temperaturas, liberando gases como nitrogênio, oxigênio e vapor d’água. A temperatura de decomposição do NH4NO3 varia dependendo da pureza, umidade e presença de impurezas ou aditivos. A temperatura de decomposição do NH4NO3 puro é de aproximadamente 210°C ou 483 K.
Ponto de fusão do nitrato de amônio
O ponto de fusão do NH4NO3 é 169,6 °C ou 442,8 K. Ele sofre uma transição de fase de uma estrutura cristalina romboédrica para uma estrutura cristalina cúbica nesta temperatura. Também pode formar uma mistura eutética com água, que possui um ponto de fusão inferior em torno de -16 °C ou 257 K.
Densidade de nitrato de amônio g/ml
A densidade do NH4NO3 é 1,725 g/ml ou 1725 kg/m3 à temperatura e pressão ambiente. É mais denso que a água, que tem densidade de aproximadamente 1 g/ml ou 1000 kg/m3 nas mesmas condições. A densidade do NH4NO3 diminui à medida que a temperatura aumenta, devido à expansão térmica.
Peso molecular do nitrato de amônio
O peso molecular do NH4NO3 é igual à sua massa molar, que é 80,043 g/mol. O peso molecular é a massa de um mol ou 6,022 x 10^(23) moléculas de NH4NO3. O peso molecular também pode ser expresso em unidades de massa atômica (amu), definidas como um duodécimo da massa de um átomo de carbono-12.
O peso molecular de NH4NO3 em amu é 80,043 x (1/12) x (10 ^ (23)) amu
O peso molecular de NH4NO3 em amu é aproximadamente 6,669 x 10 ^ (23) amu
Estrutura do nitrato de amônio
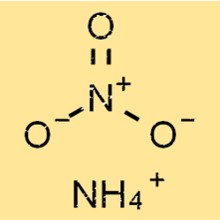
NH4NO3 possui uma estrutura iônica simples, composta de íons de amônio com carga positiva e íons de nitrato com carga negativa. O íon amônio tem forma tetraédrica, com quatro átomos de hidrogênio ligados a um átomo central de nitrogênio por ligações covalentes.
NH4+
H
|
HNH
|
H
O íon nitrato tem forma trigonal planar, com três átomos de oxigênio ligados a um átomo central de nitrogênio por ligações covalentes, uma das quais é uma ligação dupla.
N ° 3-
Oh
||
Oh
Solubilidade do nitrato de amônio
A solubilidade do NH4NO3 refere-se à quantidade deste composto que se dissolve em água ou outros solventes. NH4NO3 é muito solúvel em água e sua solubilidade aumenta com a temperatura. Por exemplo, a 20°C, 150 g de NH4NO3 podem dissolver-se em 100 ml de água, mas a 100°C, 1024 g podem dissolver-se na mesma quantidade de água. NH4NO3 também se dissolve em metanol, etanol e acetona, mas não em éter dietílico ou clorofórmio. A solubilidade do NH4NO3 depende da presença de outras substâncias, como ácidos, bases, sais ou compostos orgânicos. Algumas dessas substâncias podem afetar a estabilidade do NH4NO3 e causar sua decomposição ou explosão.
| Aparência | Sólido cristalino branco |
| Densidade específica | 1.725 |
| Cor | Branco ou cinza |
| Cheiro | Inodoro |
| Massa molar | 80,043 g/mol |
| Densidade | 1,725 g/ml ou 1725 kg/m3 |
| Ponto de fusão | 169,6°C ou 442,8K |
| Ponto de ebulição | Aproximadamente. 210°C ou 483 K (decompõe-se) |
| Ponto flash | Não inflamável |
| Solubilidade em Água | Endotérmico, 118g/100ml (0°C), 150g/100ml (20°C), 297g/100ml (40°C), 410g/100ml (60°C), 576g/100ml (80°C), 1024g/100ml (100ºC) |
| Solubilidade | Solúvel em água, metanol, etanol, acetona; insolúvel em éter dietílico, clorofórmio |
| Pressão de vapor | Insignificante à temperatura ambiente |
| Densidade do vapor | Não aplicável (sólido) |
| pKa | 9,25 (para NH4+) |
| pH | 5,0-6,0 (solução aquosa a 10%) |
Segurança e perigos do nitrato de amônio
A segurança e os perigos do NH4NO3 são importantes para qualquer pessoa que manuseie ou armazene este composto químico. NH4NO3 é um oxidante que pode intensificar um incêndio e causar explosões se misturado com materiais combustíveis ou exposto a calor, choque ou contaminação. NH4NO3 também pode liberar gases tóxicos, como óxidos de nitrogênio e amônia, quando decomposto. Portanto, as pessoas devem seguir estas precauções de segurança ao manusear NH4NO3:
- Armazene-o em local fresco, seco e bem ventilado, longe de fontes de fogo, substâncias orgânicas, ácidos, metais e outros materiais incompatíveis.
- Use roupas de proteção, luvas e proteção para os olhos e rosto durante o manuseio.
- Evite criar poeira e use ventilação adequada durante a transferência.
- Lave bem as mãos e o rosto após o manuseio.
- Não ingerir ou inalar e consultar um médico em caso de exposição.
- Informe os socorristas locais sobre a presença de NH4NO3 nas instalações e prepare um plano de resposta a emergências.
| Símbolos de perigo | O (agente oxidante), Xi (irritante) |
| Descrição de segurança | S17 (manter afastado de materiais combustíveis), S26 (em caso de contacto com os olhos, lavar imediata e abundantemente com água e consultar um médico), S36/37/39 (usar vestuário de proteção, luvas e proteção ocular/facial adequados), S42 (durante a fumigação/pulverização, use equipamento respiratório adequado) |
| Números de identificação da ONU | S17 (manter afastado de materiais combustíveis), S26 (em caso de contacto com os olhos, lavar imediata e abundantemente com água e consultar um médico), S36/37/39 (usar vestuário de proteção, luvas e proteção ocular/facial adequados), S42 (durante a fumigação/pulverização, use equipamento respiratório adequado) |
| Código SH | 3102.30 (nitrato de amônio, mesmo em solução aquosa) |
| Classe de perigo | 5.1 (agente oxidante) |
| Grupo de embalagem | III (baixo perigo) |
| Toxicidade | LD50 (oral, rato) = 2.085-5.300 mg/kg |
Métodos de síntese de nitrato de amônio
Para produzir esse composto químico, amplamente utilizado como fertilizante e explosivo, os químicos utilizam vários métodos de síntese de NH4NO3. Existem diferentes métodos para sintetizar NH4NO3, mas os mais comuns são:
- O processo Haber-Bosch e Ostwald: Este método envolve a reação dos gases nitrogênio e hidrogênio para formar amônia e, em seguida, a oxidação da amônia com ar para formar ácido nítrico . Para formar NH4NO3, eles neutralizam a amônia e o ácido nítrico. Este método requer alta temperatura, pressão e energia e emite muito dióxido de carbono.
- A reação de metátese: Este método envolve a reação de um sal de amônio solúvel com um sal de nitrato solúvel para formar NH4NO3 e outro sal. Por exemplo, o sulfato de amônio e o nitrato de bário podem reagir para formar NH4NO3 e sulfato de bário. Este método é simples e não requer alta temperatura ou pressão, mas produz um subproduto que pode precisar ser separado ou descartado.
- O processo de plasma: Este método consiste na utilização de um plasma em baixa temperatura e baixa pressão para fixar o nitrogênio do ar no solo, formando assim NH4NO3 diretamente no solo. Este método não requer gás hidrogênio ou catalisadores e não emite dióxido de carbono. Também pode enriquecer o solo com nitrogênio e melhorar o crescimento das plantas.
Usos do nitrato de amônio
Aqui estão alguns usos do NH4NO3:
- Fertilizante: NH4NO3 é uma fonte comum de nitrogênio para as plantas, pois contém aproximadamente 33,5% de nitrogênio, todo disponível para absorção pelas plantas. Os fabricantes revestem pellets de carbonato de amônio branco ou cinza com argila para evitar que endureçam e absorvam umidade. Podem aplicá-lo na forma sólida ou em solução porque a água o dissolve facilmente.
- Explosivo: NH4NO3 é um agente oxidante que pode potencializar a detonação de outros explosivos, como nitroglicerina, TNT, RDX ou pó de alumínio. Um explosivo industrial amplamente utilizado, que representa 80% dos explosivos utilizados na América do Norte, contém ANFO (NH4NO3 e óleo combustível) como ingrediente principal. Requer um iniciador poderoso para detoná-lo quando usado em dispositivos explosivos improvisados, mas aplicações industriais também podem utilizá-lo.
- Pirotecnia: Os fogos de artifício podem usar NH4NO3 para criar vários efeitos, como fumaça, faíscas, estrelas e relâmpagos. Também podem ser utilizadas compressas frias, que produzem uma reação endotérmica quando misturadas com água.
- Outros usos: Utilizado como precursor do óxido nitroso (gás hilariante), anestésico e propelente. Os óxidos de nitrogênio podem ser usados como absorventes, leveduras e antibióticos podem ser usados como nutrientes e misturas para freezer podem ser usadas como componentes.
Questões:
P: De onde vem o fertilizante de nitrato de amônio?
R: O fertilizante NH4NO3 é um produto sintético resultante da reação da amônia e do ácido nítrico. A amônia é obtida do gás natural ou de outras fontes, e o ácido nítrico é produzido pela oxidação da amônia com o ar. O fertilizante NH4NO3 também pode ser produzido usando um processo de plasma que fixa o nitrogênio do ar no solo.
P: O que é nitrato de amônio?
R: NH4NO3 é um composto químico com a fórmula NH4NO3. É um sal cristalino branco composto por íons amônio e nitrato. É altamente solúvel em água e higroscópico na forma sólida, embora não forme hidratos.
P: Para que é usado o nitrato de amônio?
R: O NH4NO3 é usado principalmente para dois propósitos: como fertilizante e como explosivo. Como fertilizante, fornece nitrogênio às plantas, essencial para seu crescimento e metabolismo. Como explosivo, atua como oxidante que promove a detonação de outros explosivos, como ANFO (NH4NO3 e óleo combustível) 1 . Também pode ser usado para outros fins, como produção de óxido nitroso (gás hilariante), compressas frias, fogos de artifício e nutrientes de levedura.
P: Qual é a fórmula molecular do nitrato de amônio?
R: A fórmula molecular do nitrato de amônio é NH4NO3. Tem massa molar de 80.043 g/mol e contém 35% de nitrogênio em massa.
P: De que é feito o fertilizante de nitrato de amônio?
R: O fertilizante NH4NO3 é composto de NH4NO3 e às vezes outros aditivos, como argila, agentes antiaglomerantes ou estabilizantes. A qualidade comercial contém aproximadamente 33,5% de nitrogênio, tudo em formas disponíveis para absorção pelas plantas.
P: O nitrato de amônio é um ácido ou uma base?
R: NH4NO3 não é um ácido nem uma base, mas um sal. Pode dissociar-se em água em íons amônio e nitrato, que podem atuar como ácidos ou bases fracas dependendo do pH da solução. O íon amônio tem pKa de 9,25, o que significa que pode doar um próton e atuar como ácido em soluções básicas. O íon nitrato não tem pKa, o que significa que não pode doar ou aceitar prótons, mas pode atuar como base, formando ácido nítrico com íons hidrônio em soluções ácidas.
P: Explosão de nitrato de amônio?
R: Uma explosão de NH4NO3 é uma reação química violenta que ocorre quando o NH4NO3 se decompõe rapidamente e libera grandes quantidades de gases, como nitrogênio, oxigênio e vapor de água. A decomposição pode ser desencadeada por calor, choque, fricção, contaminação ou confinamento. Uma explosão de NH4NO3 pode causar sérios danos a edifícios, pessoas e ao meio ambiente. Alguns exemplos de explosões de NH4NO3 são o desastre de Texas City em 1947, a explosão de Oppau em 1921, a explosão de Tianjin em 2015 e a explosão em Beirute em 2020.
P: Como comprar nitrato de amônio?
R: A compra de NH4NO3 pode exigir uma licença ou autorização dependendo do país ou região em que você mora. Na verdade, o NH4NO3 pode ser utilizado para fabricar explosivos ou dispositivos explosivos improvisados que possam representar uma ameaça à segurança pública. Você também pode ser solicitado a fornecer sua identidade, endereço, detalhes de contato e uso pretendido do produto ao comprar NH4NO3. O NH4NO3 pode ser adquirido de fornecedores ou distribuidores aprovados que cumpram os regulamentos e padrões locais. Você também deve seguir as diretrizes adequadas de armazenamento e manuseio para evitar acidentes ou uso indevido de NH4NO3.
