O que é amônio NH4+?
O íon amônio (NH4+) é um íon poliatômico carregado positivamente que consiste em um átomo de nitrogênio e quatro átomos de hidrogênio. É comumente encontrado em fertilizantes e compostos orgânicos.
| Nome IUPAC | Azânio |
| Fórmula molecular | NH4+ |
| Número CAS | 14798-03-9 |
| Sinônimos | Cátion amônio, tetrahidridonitrogênio (1+), aminônio, azânio, cátion hidreto de nitrogênio, hidronitrogênio, íon nitrogênio |
| InChI | InChI=1S/H3N/h1H3/p+1 |
Nota: InChI diz respeito ao íon amônio em sua forma mais simples, com um único hidrogênio ionizado. O InChI real pode variar dependendo do ambiente químico do íon amônio.
Fórmula de amônio
A fórmula do íon amônio é NH4+. É um cátion poliatômico composto por um átomo de nitrogênio e quatro átomos de hidrogênio. O íon amônio é formado pela protonação da amônia (NH3) com um íon hidrogênio (H+). O íon amônio é um cátion comum em compostos inorgânicos e orgânicos, incluindo fertilizantes, produtos farmacêuticos e explosivos.
Cátion amônio
O cátion amônio, também conhecido como NH4+, é um íon poliatômico carregado positivamente composto por um átomo de nitrogênio e quatro átomos de hidrogênio. É formado quando a amônia (NH3) aceita um próton (H+) de um ácido, resultando na formação de sal de amônio.
Massa molar de íons de amônio
A massa molar do íon amônio (NH4+) é 18,04 g/mol. Este valor é calculado somando as massas atômicas de um átomo de nitrogênio (14,01 g/mol) e quatro átomos de hidrogênio (1,01 g/mol cada). A massa molar é uma propriedade importante do íon amônio porque permite a conversão de sua massa em moles e vice-versa. Isso é útil em muitos cálculos químicos, como na determinação da quantidade de reagentes necessários para uma reação química.
Ponto de ebulição dos íons de amônio
Como o íon amônio é geralmente encontrado em um sal, como o cloreto de amônio (NH4Cl), ele não possui ponto de ebulição próprio. Em vez disso, o ponto de ebulição do cloreto de amônio, que é 520 °C, é influenciado por vários fatores, como a força da ligação iônica entre o íon amônio e o íon cloreto, bem como o tamanho e a forma do íon amônio.
Ponto de fusão de íons de amônio
Semelhante ao ponto de ebulição, o íon amônio não tem ponto de fusão porque não é uma substância que existe na forma pura. No entanto, os sais que contêm o íon amônio, como o nitrato de amônio (NH4NO3), têm um ponto de fusão de 169,6°C. O ponto de fusão do nitrato de amônio é influenciado pela força da ligação iônica entre o íon amônio e o íon nitrato, bem como pela estrutura cristalina do composto.
Densidade de íons de amônio g/ml
A densidade do íon amônio (NH4+) não é aplicável porque é um íon poliatômico e não existe como uma entidade separada. Porém, os sais que contêm o íon amônio, como o sulfato de amônio (NH4)2SO4, apresentam densidade de 1,77 g/cm³ à temperatura ambiente. A densidade dos sais contendo o íon amônio é influenciada por vários fatores, incluindo o tamanho e a forma dos íons, a força da ligação iônica e a estrutura cristalina do composto.
Peso molecular de íons de amônio
O peso molecular do íon amônio (NH4+) é 18,04 g/mol, calculado pela soma das massas atômicas de um átomo de nitrogênio e quatro átomos de hidrogênio. O peso molecular é uma propriedade importante do íon amônio porque permite a conversão de sua massa em moles e vice-versa. Isso é útil em muitos cálculos químicos, como na determinação da quantidade de reagentes necessários para uma reação química.
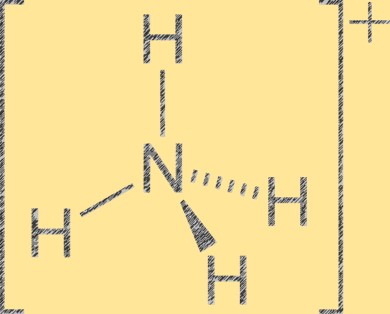
Estrutura dos íons de amônio
O íon amônio (NH4+) tem uma geometria molecular tetraédrica com um átomo de nitrogênio no centro e quatro átomos de hidrogênio nos cantos do tetraedro. O átomo de nitrogênio tem carga formal positiva de +1, enquanto cada átomo de hidrogênio tem carga formal de -1. O íon amônio é um cátion poliatômico formado pela protonação da amônia (NH3) com um íon hidrogênio (H+). O íon amônio é um cátion comum em compostos inorgânicos e orgânicos, incluindo fertilizantes, produtos farmacêuticos e explosivos.
| Aparência | Gás sólido cristalino branco ou incolor |
| Gravidade Específica | Não aplicável (íon poliatômico) |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 18,04 g/mol |
| Densidade | Não aplicável (íon poliatômico), a densidade do sal varia (por exemplo, 1,77 g/cm³ para sulfato de amônio) |
| Ponto de fusão | Não aplicável (íon poliatômico), o ponto de fusão dos sais varia (por exemplo, 169,6°C para nitrato de amônio) |
| Ponto de ebulição | Não aplicável (íon poliatômico), o ponto de ebulição dos sais varia (por exemplo, 520 °C para cloreto de amônio) |
| Ponto flash | Não aplicável (íon poliatômico) |
| Solubilidade em Água | Muito solúvel (completamente miscível) em água |
| Solubilidade | Solúvel em álcoois e amônia líquida |
| Pressão de vapor | Não aplicável (íon poliatômico) |
| Densidade do vapor | Não aplicável (íon poliatômico) |
| pKa | 9,25 (ácido conjugado, cátion amônio) |
| pH | 7 (neutro) em solução aquosa |
Nota: Os valores apresentados na tabela podem variar dependendo da forma química e das condições específicas do íon amônio.
Segurança e perigos dos íons de amônio
O íon amônio, em sua forma pura, é geralmente considerado seguro e não tóxico. No entanto, como muitos compostos químicos, o ião amónio pode representar certos perigos e riscos, especialmente se manuseado ou utilizado de forma inadequada. O íon amônio pode liberar gás tóxico amônia quando reage com bases fortes ou ácidos fortes. Também pode representar risco de incêndio e explosão quando exposto ao calor ou chamas. Além disso, a exposição a altas concentrações de íons de amônio ou seus derivados pode causar irritação nos olhos, na pele e no sistema respiratório. É importante seguir os protocolos de segurança adequados e manusear o íon amônio e seus derivados com cuidado para evitar riscos potenciais.
| Símbolos de perigo | Nenhum atribuído para íon amônio puro |
| Descrição de segurança | Nocivo se ingerido, inalado ou absorvido pela pele. Causa irritação na pele, olhos e vias respiratórias. Pode liberar gás tóxico amônia. Pode apresentar risco de incêndio e explosão. |
| UM ID | 3077 (para compostos de amônio, incluindo sais de amônio) |
| Código SH | 2827.10.00 (para cloreto de amônio, carbonato de amônio e outros sais de amônio) |
| Classe de perigo | 9 (Substâncias e objetos perigosos diversos) para compostos de amônio, Classe 8 (Substâncias corrosivas) para solução de hidróxido de amônio |
| Grupo de embalagem | III (para compostos de amônio) |
| Toxicidade | Geralmente considerado não tóxico em sua forma pura, mas pode liberar gás tóxico amônia. Os compostos e derivados de amônio podem ser tóxicos ou prejudiciais à saúde humana e ao meio ambiente, dependendo de suas propriedades e uso específicos. |
Métodos para a síntese de íons de amônio
O íon amônio pode ser sintetizado usando uma variedade de métodos, incluindo reações químicas e processos biológicos.
Um método comum para sintetizar o íon amônio é reagir o gás amônia com um ácido, como ácido clorídrico ou ácido sulfúrico, para produzir sal de amônio. A reação envolve o deslocamento de íons hidrogênio (H+) no ácido por moléculas de amônia, resultando na formação do cátion amônio (NH4+) e do ânion correspondente do ácido (por exemplo, cloreto, sulfato). O sal de amônio resultante pode ser purificado e cristalizado para obter um íon amônio.
Processos biológicos, como a decomposição da matéria orgânica por micróbios, também podem resultar na formação de íons amônio. Durante este processo, os compostos contendo nitrogênio são decompostos por bactérias e outros microorganismos, produzindo amônia e, eventualmente, íons de amônio. Este processo é conhecido como amonificação e é uma etapa importante no ciclo do nitrogênio.
Outro método de sintetizar o íon amônio é usar o processo Haber-Bosch, que envolve a reação do gás nitrogênio e do gás hidrogênio na presença de um catalisador em alta pressão e temperatura. O gás amônia resultante pode então reagir com um ácido para produzir um íon amônio.
Usos de íons de amônio
O íon amônio tem vários usos em ambientes industriais, agrícolas e laboratoriais.
Atende uma ampla variedade de ambientes industriais, agrícolas e laboratoriais, pois atua principalmente como fertilizante na agricultura, fornecendo nitrogênio prontamente disponível às plantas e, ao mesmo tempo, reduzindo o pH do solo.
A indústria química utiliza o íon amônio como ingrediente chave na produção de diversos compostos, como fertilizantes, explosivos e produtos farmacêuticos, bem como na síntese de antibióticos e outros produtos farmacêuticos. O íon amônio também funciona como explosivo na forma de nitrato de amônio.
Em laboratórios, os pesquisadores utilizam o íon amônio como reagente em muitas reações químicas, como reações de precipitação e síntese orgânica, e como agente tampão para estabilizar o pH da solução.
Além disso, o íon amônio é usado em produtos de limpeza doméstica como agente antimicrobiano devido à sua capacidade de matar bactérias e fungos.
Os múltiplos usos do íon amônio e sua versatilidade fazem dele um composto essencial em diversas indústrias e aplicações.
