O iodo (I2) é uma molécula composta por dois átomos de iodo. É um sólido de cor escura à temperatura ambiente e pode sublimar em vapor roxo quando aquecido. O iodo é um elemento essencial para a produção dos hormônios da tireoide em humanos.
| Nome IUPAC | Diiodo |
| Fórmula molecular | I2 |
| Número CAS | 7553-56-2 |
| Sinônimos | Iodo molecular, iodo molecular, cristais de iodo, iodo sublimado, iodo diatômico |
| InChI | InChI=1S/I2/c1-2 |
Propriedades do iodo
Fórmula de iodo
A fórmula química do iodo é I2, o que indica que ele é composto por dois átomos de iodo. A fórmula é escrita usando os símbolos dos elementos e subscritos para indicar o número de átomos presentes. A fórmula do iodo é essencial para determinar as propriedades químicas do iodo e para escrever reações químicas envolvendo o iodo.
Massa molar de iodo
A massa molar de I2 é aproximadamente 253,81 g/mol. É um elemento halogênio que pertence ao mesmo grupo do flúor, cloro, bromo e astato. A massa molar de I2 é calculada somando as massas atômicas de seus dois átomos, que são 126,90 g/mol cada. A massa molar de I2 desempenha um papel crucial na determinação da quantidade de I2 presente em uma determinada amostra.
Ponto de ebulição do iodo
O ponto de ebulição do I2 é 184,3°C, tornando-o um sólido à temperatura ambiente. Quando aquecido, o I2 sublima diretamente em um gás violeta sem passar pela fase líquida. O ponto de ebulição do I2 é relativamente baixo em comparação com outros halogênios, como cloro e bromo. Este baixo ponto de ebulição permite que o I2 seja facilmente purificado por sublimação.
Ponto de fusão do iodo
I2 tem um ponto de fusão de 113,7°C, que é relativamente baixo em comparação com outros halogênios. Este baixo ponto de fusão significa que o I2 pode ser facilmente derretido e utilizado em diversas aplicações, como fotografia e produção de cristais de I2. Além disso, o ponto de fusão do I2 está próximo do ponto de ebulição, facilitando a purificação por sublimação.
Densidade de iodo g/mL
A densidade de I2 é de aproximadamente 4,93 g/mL à temperatura e pressão ambientes. Isso significa que I2 é mais denso que a água, que tem densidade de 1 g/mL. A alta densidade do I2 o torna útil em diversas aplicações, como na produção de compostos orgânicos e como agente de contraste em imagens médicas.
Peso molecular do iodo
O peso molecular de I2 é calculado somando os pesos atômicos de seus dois átomos. O peso atômico do I2 é 126,90 g/mol, o que significa que seu peso molecular é de aproximadamente 253,81 g/mol. O peso molecular do I2 é um fator importante na determinação de suas propriedades físicas e químicas.
Estrutura do iodo
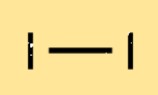
I2 é uma molécula diatômica, o que significa que é composta de dois átomos I. Esses átomos são mantidos juntos por uma ligação covalente que se forma quando os átomos compartilham elétrons. A ligação entre os dois átomos é relativamente fraca, razão pela qual I2 tem um ponto de fusão e ebulição baixo em comparação com outros halogênios.
| Aparência | Sólido cristalino cinza-preto escuro |
| Gravidade Específica | 4,93g/cm³ |
| Cor | Violeta (vapor), preto acinzentado escuro (sólido) |
| Cheiro | Pungente, sufocante |
| Massa molar | 253,81 g/mol |
| Densidade | 4,93g/cm³ |
| Ponto de fusão | 113,7ºC |
| Ponto de ebulição | 184,3ºC |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 0,03 g/100 mL a 20°C |
| Solubilidade | Solúvel em solventes orgânicos, como etanol, éter e clorofórmio |
| Pressão de vapor | 0,4 mmHg a 25°C |
| Densidade do vapor | 8,7 (ar = 1) |
| pKa | 10.3 |
| pH | Não aplicável |
Segurança e perigos do iodo
I2 pode ser perigoso se não for manuseado corretamente. Pode causar irritação grave e queimaduras na pele e nos olhos, e pode ser tóxico se ingerido em grandes quantidades. A inalação de vapores I2 também pode causar problemas respiratórios. O I2 deve ser armazenado em local fresco, seco e bem ventilado, longe do calor e de fontes de ignição. Equipamentos de proteção individual adequados, como luvas, óculos de proteção e respirador, devem ser usados ao manusear I2. Se expostas, as áreas afetadas devem ser lavadas com água e procurar atendimento médico imediatamente. É importante seguir os protocolos de segurança adequados ao manusear o I2 para evitar quaisquer perigos potenciais.
| Símbolos de perigo | T (tóxico), Xn (prejudicial) |
| Descrição de segurança | Manter afastado do calor/faísca/chama aberta/superfícies quentes. Não respirar poeiras/fumos/gases/névoas/vapores/aerossóis. Use luvas/roupas/proteção ocular/proteção facial. EM CASO DE INALAÇÃO: Remover a vítima para um local ao ar livre e mantê-la em repouso numa posição confortável para respirar. EM CASO DE INGESTÃO: Enxágue a boca. NÃO induza o vômito. SE ENTRAR EM CONTACTO COM A PELE (ou cabelo): Remova imediatamente todas as roupas contaminadas. Enxaguar a pele com água/tomar banho. |
| Números de identificação da ONU | ONU 3490 (Iodo), ONU 3491 (Iodo sólido) |
| Código SH | 2801.20 |
| Classe de perigo | 6.1 (Substâncias tóxicas) |
| Grupo de embalagem | II |
| Toxicidade | O iodo pode ser tóxico se ingerido em grandes quantidades e causa irritação grave e queimaduras na pele e nos olhos. A inalação de vapor de iodo também pode causar problemas respiratórios. |
Métodos para a síntese de iodo
Vários métodos podem sintetizar I2.
Um método comum é oxidar íons iodeto com agentes oxidantes, como cloro ou ácido nítrico . A reação de Sandmeyer é o nome deste método.
Outro método envolve a reação do ICl com iodeto de potássio . A reação Merck é o nome deste método.
O I2 também pode ser obtido a partir de algas, que são uma fonte natural de I2. O processo envolve a colheita e queima de algas para extrair I2 das cinzas. A reação de Calvert-Lewin é o nome deste método.
A reação entre iodeto de hidrogênio e peróxido de hidrogênio pode sintetizar I2. O processo Dowd é o nome deste método.
Outro método envolve a reação de iodeto e fósforo, que produz triiodeto de fósforo e fósforo vermelho. O triiodeto de fósforo sofre hidrólise para produzir I2.
Existem vários outros métodos de síntese de I2, incluindo a reação do iodeto com hidróxido de potássio, a reação do iodeto e do ácido sulfúrico e a eletrólise de soluções de iodeto. A escolha do método depende da aplicação específica e da disponibilidade de matéria-prima.
Usos do iodo
I2 tem uma ampla gama de utilizações em diversas indústrias e aplicações. Aqui estão alguns dos usos mais comuns do I2:
- Medicina: Utilizado na medicina como agente anti-séptico, desinfetante e esterilizante. Também trata distúrbios da tireoide, como bócio e hipertireoidismo.
- Fotografia: Para produzir um material sensível à luz para fotografia, os fabricantes usam I2 na criação de iodeto de prata.
- Agricultura: Usado como nutriente do solo para promover o crescimento das plantas e prevenir a deficiência de iodo na pecuária.
- Indústria alimentar: Para prevenir a deficiência de iodo, as pessoas adicionam I2 como suplemento dietético ao sal e outros alimentos.
- Tratamento de água: Usado como desinfetante de água e para remover impurezas da água.
- Indústria química: utilizada na produção de diversos produtos químicos, como polímeros, corantes e produtos farmacêuticos.
- Química Analítica: Utilizada como reagente em química analítica para detectar a presença de amido, lipídios e outros compostos.
- Energia nuclear: Medicina nuclear e tratamento de câncer usam I-131.
- Pesquisa Científica: Também utilizado em pesquisas científicas para estudar diversos processos químicos e biológicos.
Questões:
P: O iodo é um metal?
R: Não, I2 não é um metal. É um não metal.
P: Quantos elétrons de valência o iodo possui?
R: O iodo tem 7 elétrons de valência.
P: O que é iodo?
R: I2 é um elemento químico com símbolo I e número atômico 53. É um não metal essencial à saúde humana e possui diversas aplicações industriais e científicas.
P: Para que é usado o iodo?
R: O I2 tem uma ampla gama de utilizações, inclusive como anti-séptico, desinfetante, suplemento dietético, agente de tratamento de água, nutriente do solo e na produção de diversos produtos químicos, farmacêuticos e polímeros.
P: I2 é polar ou apolar?
R: I2 (iodo) é uma molécula apolar.
P: Qual é a taxa média de treinamento do i2?
R: A taxa média de formação de I2 depende da reação específica e das condições envolvidas e deve ser calculada experimentalmente ou por análise teórica.
P: O que é I2?
R: I2 é a fórmula química do iodo, um elemento não metálico que faz parte do grupo dos halogênios da tabela periódica. É um sólido roxo escuro à temperatura ambiente e um halogênio com diversas aplicações industriais e médicas.
