O iodeto de magnésio é um composto químico com a fórmula MgI2. É um sólido cristalino branco altamente solúvel em água e álcool. MgI2 é comumente usado como fonte de iodo em reações de síntese orgânica.
| Nome da IUPAC | Iodeto de magnésio |
| Fórmula molecular | MgI2 |
| Número CAS | 10377-58-9 |
| Sinônimos | Diiodeto de magnésio, iodeto de magnésio (II), UNII-14R347R70C |
| InChI | InChI=1S/2HI.Mg/h2*1H;/q;;+2/p-2 |
Propriedades do iodeto de magnésio
Fórmula de Iodeto de Magnésio
A fórmula química do iodeto de magnésio é MgI2. Esta fórmula indica que uma molécula de iodeto de magnésio consiste em um cátion Mg2+ e dois ânions I-. A fórmula do iodeto de magnésio é útil na determinação da estequiometria das reações químicas e na previsão dos produtos das reações químicas envolvendo o composto.
Massa molar de iodeto de magnésio
MgI2 tem massa molar de 278.113 g/mol. Este valor é obtido adicionando a massa atômica de um átomo de Mg (24,305 g/mol) à massa atômica de dois átomos de I (253,808 g/mol) presentes em uma molécula de MgI2. A massa molar do MgI2 é um parâmetro importante para determinar a massa de uma determinada quantidade do composto, útil em muitas aplicações industriais e científicas.
Ponto de ebulição do iodeto de magnésio
O MgI2 tem um ponto de ebulição relativamente alto de 1309°C. Isto indica que uma quantidade considerável de energia é necessária para quebrar as forças de atração intermoleculares entre os átomos de Mg e I no composto. O ponto de ebulição do MgI2 o torna adequado para aplicações em altas temperaturas, como na fabricação de semicondutores e outros componentes eletrônicos.
Ponto de fusão do iodeto de magnésio
O ponto de fusão do MgI2 é 637°C. A esta temperatura, o MgI2 sólido passa para o estado líquido. O ponto de fusão do MgI2 é uma propriedade física importante que determina sua adequação para diversas aplicações. Por exemplo, o alto ponto de fusão torna o MgI2 ideal para uso como fundente na produção de ligas de alumínio, onde é necessário fundir metais para criar uma mistura homogênea.
Densidade de iodeto de magnésio g/mL
A densidade do MgI2 é 4,43 g/mL. Este valor indica a massa do composto presente em um determinado volume do espaço. A densidade do MgI2 é um fator importante a ser considerado ao determinar a quantidade de composto necessária para uma aplicação específica. A alta densidade do MgI2 também o torna útil como material de blindagem em reatores nucleares.
Peso molecular do iodeto de magnésio
O peso molecular do MgI2 é 278,113 g/mol. Este valor é a soma dos pesos atômicos dos elementos constituintes do composto, Mg e I. O peso molecular do MgI2 é útil para calcular a estequiometria das reações químicas e determinar o número de moles do composto presente em uma determinada amostra.
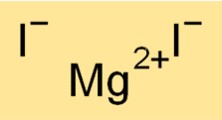
Estrutura do iodeto de magnésio
O MgI2 possui uma estrutura cristalina que pertence ao sistema cristalino hexagonal. A estrutura consiste em cátions de magnésio e ânions de iodeto dispostos em uma rede hexagonal. Os cátions Mg2+ ocupam o centro das células hexagonais, enquanto os ânions I- ocupam os cantos das células. A estrutura cristalina do MgI2 contribui para suas propriedades físicas e químicas, como seus altos pontos de fusão e ebulição.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 4,43g/ml |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 278.113 g/mol |
| Densidade | 4,43g/ml |
| Ponto de fusão | 637°C |
| Ponto de ebulição | 1.309°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Solúvel |
| Solubilidade | Solúvel em álcool, acetona |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Não aplicável |
Segurança e perigos do iodeto de magnésio
O MgI2 é geralmente considerado seguro quando manuseado e usado corretamente. No entanto, como qualquer composto químico, pode representar certos perigos se não for manuseado com cuidado. O MgI2 é classificado como irritante para a pele e os olhos, e a exposição prolongada ao composto pode causar sensibilização da pele ou irritação respiratória. É importante usar equipamento de proteção individual adequado ao manusear MgI2, incluindo luvas, proteção para os olhos e respirador, se necessário. Além disso, o MgI2 pode reagir violentamente com a água, liberando gás hidrogênio inflamável. Portanto, deve ser armazenado e manuseado longe de fontes de umidade.
| Símbolos de perigo | Xi: Irritante |
| Descrição de segurança | S22: Não respirar as poeiras. S24: Evitar contato com a pele. S36/37/39: Use roupas de proteção, luvas e proteção para os olhos/face adequados. |
| Números de identificação da ONU | UN3077 |
| Código SH | 28276000 |
| Classe de perigo | 9: Mercadorias perigosas diversas |
| Grupo de embalagem | III |
| Toxicidade | Baixa toxicidade |
Métodos de síntese de iodeto de magnésio
Existem vários métodos para sintetizar MgI2, cada um com suas vantagens e limitações.
Um método comum envolve a reação do magnésio metálico com iodo em um solvente de éter anidro ou tetrahidrofurano (THF). Esta reação produz MgI2 na forma de um precipitado sólido branco.
Outro método envolve a reação de óxido de magnésio ou hidróxido de magnésio com ácido iodídrico. Este método geralmente envolve o aquecimento de óxido ou hidróxido de magnésio com ácido iodídrico para produzir MgI2.
A reação do carbonato de magnésio ou óxido de magnésio com gás iodeto de hidrogênio também produz MgI2. Esta reação geralmente ocorre em altas temperaturas e produz MgI2 como um produto sólido branco.
No geral, a escolha do método de síntese do MgI2 dependerá de fatores como a pureza desejada do produto final, a disponibilidade de matérias-primas e as condições sob as quais a síntese será realizada.
Usos do iodeto de magnésio
O MgI2 tem muitos usos em diferentes campos devido às suas propriedades únicas. Aqui estão algumas aplicações comuns de MgI2:
- Como catalisador: utilizado como catalisador em reações químicas orgânicas, principalmente na formação de ligações carbono-carbono.
- Na preparação de reagentes de Grignard: Utilizado na preparação de reagentes de Grignard. Os químicos orgânicos usam reagentes de Grignard para sintetizar uma ampla gama de compostos orgânicos.
- Medicinalmente: Usado medicinalmente como suplemento para fornecer ao corpo magnésio e iodo essenciais, importantes para manter funções corporais saudáveis.
- Em reatores nucleares: usado em reatores nucleares como absorvedor de nêutrons para controlar a taxa de reações de fissão.
- Processamento fotográfico: utilizado no processamento fotográfico como agente estabilizador para prevenir a oxidação e degradação de filmes fotográficos.
- Na produção do magnésio metálico: também utilizado como precursor na produção do magnésio metálico, que possui ampla gama de aplicações em diversas indústrias.
Questões:
P: Que tipo de dissolução o MgI2 sofreria?
R: O MgI2 sofreria dissolução iônica devido à sua natureza de composto iônico.
P: Qual é a fórmula química do iodeto de magnésio?
R: A fórmula química do iodeto de magnésio é MgI2.
P: O MgI2 é solúvel?
R: Sim, o MgI2 é solúvel em água, álcool e éter.
P: Qual é a fórmula do iodeto de magnésio?
R: A fórmula do iodeto de magnésio é MgI2.
P: Que tipo de composto é MgI2?
R: MgI2 é um composto iônico, formado pela transferência de dois elétrons do magnésio para o iodo.
P: Qual composto tem a fórmula química MgI2?
R: O composto com a fórmula química MgI2 é o iodeto de magnésio.
P: Qual é o nome do composto com a fórmula MgI2?
R: O nome do composto com a fórmula MgI2 é Iodeto de Magnésio.
