Octanagem é um combustível de alta octanagem usado em motores de combustão. Melhora o desempenho do motor, reduz a detonação e aumenta a potência. É comumente usado em veículos de alto desempenho e carros de corrida.
| Nome IUPAC | Octano |
| Fórmula molecular | C8H18 |
| Número CAS | 111-65-9 |
| Sinônimos | n-octano, octano normal, octano |
| InChI | InChI=1S/C8H18/c1-3-5-7-8-6-4-2/h3-8H2.1-2H3 |
Propriedades de octanagem
Fórmula de octanagem
A fórmula da octanagem é C8H18. Consiste em oito átomos de carbono e dezoito átomos de hidrogênio. Esta fórmula molecular representa o arranjo dos átomos em uma única molécula de octano.
Massa molar de octano
A massa molar do octano é calculada somando as massas atômicas de todos os átomos de sua fórmula química. A massa molar do octano é de aproximadamente 114,22 gramas por mol. Isto é importante em vários cálculos que envolvem a quantidade de octanas em uma determinada amostra.
Ponto de ebulição do número de octanas
Octan tem um ponto de ebulição de cerca de 125,5 graus Celsius (257,9 graus Fahrenheit). Esta é a temperatura na qual o octano muda de uma fase líquida para uma fase gasosa. O ponto de ebulição do octano é influenciado por sua estrutura molecular e forças intermoleculares.
Ponto de fusão de octanas
Octan tem um ponto de fusão de cerca de -57 graus Celsius (-70,6 graus Fahrenheit). Esta é a temperatura na qual o octano muda de sólido para líquido. O ponto de fusão do octano depende de fatores como estrutura molecular e forças intermoleculares.
Densidade de octanas g/mL
A densidade do octano é de aproximadamente 0,703 gramas por mililitro (g/mL). A densidade é uma medida da massa por unidade de volume de uma substância. A densidade da octanagem é inferior à da água, que tem densidade de 1 g/mL, indicando que a octanagem é menos densa que a água.
Peso molecular de octanagem
O peso molecular do octano é de aproximadamente 114,22 gramas por mol. É a soma dos pesos atômicos de todos os átomos de uma molécula de octano. O peso molecular é crucial em vários cálculos, como na determinação da quantidade de octanas necessária em uma reação.
Estrutura de octanagem
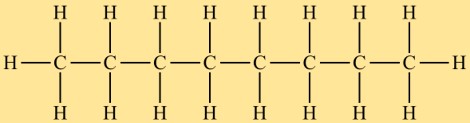
Octan pertence à classe dos alcanos e possui uma estrutura linear. Consiste em uma cadeia de oito átomos de carbono com átomos de hidrogênio ligados a eles. O arranjo dos átomos no octano é tal que não há estrutura ramificada ou cíclica.
Solubilidade do número de octanas
Octan é considerado insolúvel em água. Apresenta baixa solubilidade em solventes polares devido à sua natureza apolar. No entanto, o octano é altamente solúvel em solventes apolares, como outros hidrocarbonetos, óleos e solventes orgânicos.
| Aparência | Líquido incolor |
| Gravidade Específica | 0,703g/ml |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 114,22 g/mol |
| Densidade | 0,703g/ml |
| Ponto de fusão | -57°C (-70,6°F) |
| Ponto de ebulição | 125,5°C (257,9°F) |
| Ponto flash | -18°C (0°F) |
| Solubilidade em Água | Insolúvel |
| Solubilidade | Solúvel em solventes não polares |
| Pressão de vapor | 12,9 mmHg a 20°C |
| Densidade do vapor | 3,47 (ar = 1) |
| pKa | ~45 |
| pH | Neutro |
Segurança e perigos do octano
Octan apresenta certos riscos de segurança que precisam ser considerados. É altamente inflamável e pode inflamar-se facilmente, representando risco de incêndio. Os vapores do octano podem formar misturas explosivas com o ar, aumentando o risco de incêndios e explosões. É importante manusear o octan com cautela, garantindo ventilação adequada e evitando fontes de ignição. O contato da pele com octan pode causar irritação e ressecamento. A ingestão ou inalação de octano pode causar riscos à saúde, incluindo irritação respiratória e efeitos no sistema nervoso central. É essencial seguir as precauções de segurança, utilizar equipamentos de proteção individual adequados e manter o octan longe de substâncias incompatíveis.
| Símbolos de perigo | Inflamável (F), Irritante (Xi) |
| Descrição de segurança | Manter afastado do calor/faísca/chama aberta. Usar em uma área bem ventilada. Evitar o contato com a pele e os olhos. |
| Números de identificação da ONU | ONU 1262 |
| Código SH | 2901.10.10 |
| Classe de perigo | 3 – Líquidos inflamáveis |
| Grupo de embalagem | III |
| Toxicidade | Fraco |
Métodos de síntese de octanas
Vários métodos podem sintetizar o octano. Um método comum é reformar cataliticamente frações de petróleo como a nafta. O processo aquece a nafta e a faz passar por um catalisador, geralmente platina ou rênio, promovendo o rearranjo das moléculas de hidrocarbonetos. Este rearranjo produz compostos de octano superior, notadamente octano.
Outro método é alquilar isobutano com butenos. O ácido sulfúrico ou ácido fluorídrico , atuando como catalisadores ácidos, facilita a reação do isobutano, um hidrocarboneto ramificado, com hidrocarbonetos insaturados (butenos). Esta reação forma moléculas de octanagem de cadeia ramificada.
A isomerização é uma abordagem adicional para produzir octano. Ele converte hidrocarbonetos de cadeia linear como hexano ou heptano em isômeros de cadeia ramificada. Vários catalisadores, incluindo zeólitos ou catalisadores de platina, podem catalisar este processo.
Além disso, o octano pode ser obtido hidrogenando hidrocarbonetos aromáticos como tolueno ou xileno usando gás hidrogênio e um catalisador adequado. Esta reação converte compostos aromáticos em ciclohexano, que pode ser posteriormente desidrogenado para produzir octano.
Esses métodos de síntese desempenham um papel importante na produção de octano, amplamente utilizado como componente de combustível na gasolina. Utilizando essas técnicas, pode-se obter um octano com o número de octano desejado, garantindo ótimo desempenho e eficiência em motores de combustão.
Usos de octanagem
Octan encontra diversos usos em diferentes indústrias devido às suas propriedades benéficas. Aqui estão algumas aplicações principais do octan:
- Combustível: Octan é usado principalmente como componente de combustível na gasolina. Melhora a octanagem do combustível, o que melhora o desempenho do motor, reduz a detonação e evita danos ao motor. Isto é especialmente importante em veículos de alto desempenho e carros de corrida.
- Motores de Combustão: Octan é crucial para motores de combustão interna, incluindo carros, motocicletas e motores pequenos. Fornece a fonte de energia necessária para a operação e propulsão de veículos e máquinas.
- Síntese Química: Octan serve como precursor para a produção de vários produtos químicos. É utilizado como matéria-prima para a síntese de outros compostos de hidrocarbonetos, como álcoois, aldeídos e ácidos.
- Solvente de Laboratório: Octan é usado como solvente apolar em laboratórios. Sua baixa polaridade o torna adequado para dissolver compostos apolares, permitindo aos pesquisadores realizar certos experimentos e extrações.
- Referência padrão: Para determinar os números do octano e comparar o desempenho de diferentes combustíveis, pesquisadores e especialistas usam ativamente o octano como referência e composto de referência. Ajuda a estabelecer padrões de qualidade e eficiência da gasolina e de outros combustíveis de hidrocarbonetos.
- Calibração: Octan é utilizado na calibração de equipamentos, como cromatógrafos gasosos, para garantir medições precisas e precisas. Suas propriedades conhecidas e comportamento bem caracterizado fazem dele um padrão de calibração confiável.
- Pesquisa e Desenvolvimento: Octan é essencial para fins de pesquisa e desenvolvimento nas indústrias automotiva e de combustíveis. Cientistas e engenheiros estão estudando ativamente as propriedades, características de combustão e impacto ambiental do octan para melhorar a eficiência do combustível, reduzir emissões e inovar em combustíveis alternativos.
O Octan alimenta ativamente o transporte, permite a síntese química, facilita o trabalho de laboratório e impulsiona avanços nas indústrias automotiva e de energia.
Questões:
P: Qual composto tem o ponto de fusão mais alto?
R: Al2(CO3)3.
P: Qual é a entalpia padrão de formação deste isômero C8H18 (g)?
R: A entalpia padrão de formação do isômero C8H18(g) é específica para o isômero específico e exigiria sua identificação para determinar o valor.
P: Qual é a massa em gramas de 5,90 moles de C8H18?
R: A massa de 5,90 moles de C8H18 é de aproximadamente 789,26 gramas.
P: Qual afirmação compara melhor o ponto de fusão do butano (C4H10) ao do octano (C8H18)?
R: O octano (C8H18) tem um ponto de fusão mais alto que o butano (C4H10).
P: Qual é o nome de C8H18?
R: O nome do C8H18 é octano.
P: O que é octanagem?
R: O octano é um hidrocarboneto alcano com a fórmula molecular C8H18. É comumente usado como componente combustível na gasolina.
P: Qual é a octanagem da gasolina?
R: A octanagem da gasolina refere-se à sua capacidade de resistir a batidas durante a combustão. Indica as propriedades antidetonantes do combustível e sua adequação para motores de alta compressão.
P: O que são número de octanas e número de cetano?
R: O número de octanas mede as propriedades antidetonantes da gasolina, enquanto o número de cetano mede a qualidade de ignição do combustível diesel.
P: O que é octanagem?
R: A classificação Octan é um valor numérico que representa o desempenho de um combustível em resistir à detonação durante a combustão. Indica a capacidade do combustível de resistir à compressão antes da ignição.
P: Qual é o nome do hidrocarboneto CH3(CH2)6CH3?
R: O nome do hidrocarboneto CH3(CH2)6CH3 é octano.
