O hipoclorito de potássio (KClO) é um composto químico comumente usado como desinfetante e alvejante. Tem um odor forte e pode ser perigoso se não for manuseado adequadamente.
| Nome IUPAC | Hipoclorito de potássio |
| Fórmula molecular | KClO |
| Número CAS | 7778-66-7 |
| Sinônimos | Ácido hipocloroso, sal de potássio; Oxicloreto de potássio; Clorato de potássio (I) |
| InChI | InChI=1S/ClO.K/h1H;/q;+1/p-1 |
Propriedades do hipoclorito de potássio
Fórmula de hipoclorito de potássio
A fórmula química do hipoclorito de potássio é KClO. Consiste em um íon potássio, um átomo de cloro e um átomo de oxigênio. O hipoclorito de potássio é um sólido branco à temperatura ambiente e possui um forte odor de cloro. É comumente usado como desinfetante e agente de branqueamento em diversas indústrias.
Massa molar de hipoclorito de potássio
A massa molar do KClO é 90,55 g/mol. É a soma das massas atômicas dos elementos constituintes potássio, cloro e oxigênio. A massa molar é um parâmetro importante usado em estequiometria e outros cálculos químicos.
Ponto de ebulição do hipoclorito de potássio
KClO se decompõe antes de atingir seu ponto de ebulição. Seu ponto de ebulição não está, portanto, bem definido. Quando aquecido, decompõe-se em cloreto de potássio e gás oxigênio. A decomposição do KClO é uma reação exotérmica e pode ser perigosa se não for manuseada corretamente.
Ponto de fusão do hipoclorito de potássio
O ponto de fusão do KClO é de 100 a 102°C. É um sólido branco à temperatura ambiente e derrete quando aquecido. O ponto de fusão é uma propriedade física importante de uma substância e é usado para identificar e caracterizar a substância.
Densidade de hipoclorito de potássio g/ml
A densidade do KClO é 2,35 g/mL. Isto significa que um mililitro de KClO pesa 2,35 gramas. A densidade é uma medida da massa por unidade de volume de uma substância e é um parâmetro importante em cálculos químicos.
Peso molecular do hipoclorito de potássio
O peso molecular do KClO é 90,55 g/mol. É a soma dos pesos atômicos dos elementos constituintes de uma molécula de KClO. O peso molecular é usado em cálculos químicos, como determinação de massa molar e estequiometria.
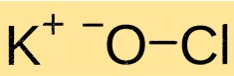
Estrutura do hipoclorito de potássio
KClO tem uma estrutura cristalina. É composto de cátions K + e ânions ClO mantidos juntos por ligações iônicas. A estrutura do KClO é semelhante à de outros compostos iônicos e é determinada pela carga e tamanho dos íons constituintes.
Solubilidade do hipoclorito de potássio
KClO é muito solúvel em água. Forma uma solução de cátions K+ e ânions ClO- quando dissolvido em água. A solubilidade do KClO em água é afetada pela temperatura e pelo pH. Temperaturas mais altas e valores mais baixos de pH aumentam a solubilidade do KClO em água.
| Aparência | Sólido branco |
| Gravidade Específica | 2,35 |
| Cor | Branco |
| Cheiro | Cheiro forte de cloro |
| Massa molar | 90,55 g/mol |
| Densidade | 2,35g/ml |
| Ponto de fusão | 100-102°C |
| Ponto de ebulição | Decompõe-se antes do ponto de ebulição |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel |
| Solubilidade | Solúvel em água |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Alcalino (pH 11-13) |
Segurança e perigos do hipoclorito de potássio
KClO pode ser perigoso se não for manuseado corretamente. É um poderoso agente oxidante que pode reagir com materiais orgânicos para produzir compostos perigosos. KClO também é um poderoso irritante para a pele, olhos e sistema respiratório. O contato direto com a pele pode causar queimaduras e irritação. A inalação de vapores de KClO pode causar tosse, respiração ofegante e falta de ar. O composto deve ser manuseado em área bem ventilada, com equipamentos de proteção individual adequados, como luvas, óculos de proteção e respirador. Em caso de exposição acidental, deve-se procurar atendimento médico imediato.
| Símbolos de perigo | Oxidante |
| Descrição de segurança | Use luvas e proteção para os olhos/face. Manter afastado de materiais combustíveis. Evitar o contato com a pele e os olhos. |
| Números de identificação da ONU | ONU1748 |
| Código SH | 2828.90.10 |
| Classe de perigo | 5.1 |
| Grupo de embalagem | II |
| Toxicidade | Pode ser perigoso se engolido. Causa queimaduras na pele e lesões oculares graves. Pode causar irritação respiratória. |
Métodos para a síntese de hipoclorito de potássio
Existem vários métodos para sintetizar hipoclorito de potássio.
Um método comum é reagir cloro gasoso com uma solução de hidróxido de potássio . A reação produz KClO e cloreto de potássio como subprodutos:
Cl2 + 2KOH → KCl + KClO + H2O
Outro método envolve a reação do hipoclorito de cálcio com cloreto de potássio . Esta reação produz KClO e cloreto de cálcio como subprodutos:
Ca(ClO)2 + 2 KCl → 2 KClO + CaCl2
Para sintetizar KClO, o ácido hipocloroso pode reagir com hidróxido de potássio .
2 KOH + HOCl → KClO + KCl + H2O
Para produzir KClO, a eletrólise pode ser usada para passar uma corrente elétrica através de uma solução de água e cloreto de potássio. A reação produz KClO, gás hidrogênio e hidróxido de potássio como subprodutos:
2 KCl + 2 H2O → 2 KOH + Cl2 + H2
O KClO sintetizado deve ser armazenado em local fresco e seco, longe da luz solar direta e do calor.
Usos do hipoclorito de potássio
KClO tem vários usos em diversas indústrias e aplicações. Aqui estão alguns de seus usos comuns:
- Tratamento de Água: Usado como desinfetante em estações de tratamento de água para matar bactérias e outros organismos prejudiciais.
- Alvejante: Utilizado como agente branqueador na indústria têxtil para branquear tecidos.
- Desinfetante: Usado como desinfetante na indústria alimentícia para desinfetar superfícies e equipamentos em contato com alimentos.
- Manutenção de Piscinas: Utilizado como desinfetante e algicida em piscinas para manter a água limpa e límpida.
- Esterilização: Usado para esterilização em ambientes médicos e laboratórios para desinfetar equipamentos e superfícies.
- Desodorizante: Utilizado como desodorizante em estações de tratamento de esgoto para neutralizar odores desagradáveis.
- Indústria de Papel e Celulose: Usado na indústria de papel e celulose como alvejante para produtos de papel.
- Agricultura: Usado na agricultura como pesticida e fungicida para proteger as plantações contra pragas e doenças.
- Desinfetante: Usado como desinfetante em produtos de limpeza doméstica para matar germes e bactérias.
- Indústria de Petróleo e Gás: Usado na indústria de petróleo e gás para tratar poços de petróleo e oleodutos para controlar bactérias e prevenir a corrosão.
Questões:
P: O que é hipoclorito de potássio?
R: O hipoclorito de potássio é um composto químico com a fórmula KClO, que é comumente usado como desinfetante, alvejante e produto químico para tratamento de água.
P: Qual é o pH de uma solução de KClO 0,42 M? [Ka(HClO) = 4,0 × 10–8]
R: O pH de uma solução 0,42 M de KClO pode ser calculado usando o valor Ka de seu ácido conjugado, HClO. O pH está em torno de 12,69.
P: O que é hipoclorito de sódio e hidróxido de potássio?
R: O hipoclorito de sódio é um composto químico com a fórmula NaClO, comumente usado como alvejante e desinfetante. O hidróxido de potássio é um composto químico de fórmula KOH, comumente utilizado na produção de sabão e como reagente de laboratório.
P: Qual é o pH de uma solução aquosa 0,116 M de KClO?
R: O pH de uma solução aquosa 0,116 M de KClO pode ser calculado usando o valor Kb de sua base conjugada, ClO-. O pH está em torno de 11,31.
P: Qual é o pH de uma solução aquosa 0,191 M de KClO?
R: O pH de uma solução aquosa 0,191 M de KClO pode ser calculado usando o valor Kb de sua base conjugada, ClO-. O pH está em torno de 11,92.
P: O KClO é solúvel?
R: Sim, o KClO é solúvel em água e forma uma solução alcalina.
P: Posso misturar hipoclorito de sódio e hipoclorito de potássio?
R: A mistura de hipoclorito de sódio e KClO não é recomendada porque pode causar uma reação química produzindo calor, gases e subprodutos potencialmente prejudiciais.
