O hipoclorito de magnésio (Mg(ClO)2) é um composto químico composto por magnésio, oxigênio e cloro. É usado como desinfetante, alvejante e produto químico para tratamento de água.
| Nome da IUPAC | Hipoclorito de magnésio |
| Fórmula molecular | Mg(ClO)2 |
| Número CAS | 10233-03-1 |
| Sinônimos | Clorato de magnésio, sal de magnésio de ácido hipocloroso, oxicloreto de magnésio, MagOCl |
| InChI | InChI=1S/Cl2O2.Mg/c1-3-2;/q-1;+2 |
Propriedades do hipoclorito de magnésio
Fórmula de hipoclorito de magnésio
O hipoclorito de magnésio tem fórmula química Mg(ClO)2, o que significa que contém um átomo de magnésio, dois átomos de cloro e dois átomos de oxigênio por molécula. É um sólido branco com leve odor de cloro e é comumente usado como desinfetante e produto químico para tratamento de água.
Massa molar de hipoclorito de magnésio
A massa molar do Mg(ClO)2 é 127,21 g/mol. Este valor é calculado somando as massas atômicas de cada elemento da fórmula química, nomeadamente magnésio (24,31 g/mol), cloro (35,45 g/mol) e oxigênio (15,99 g/mol). mol), multiplicados pelos seus respectivos índices.
Ponto de ebulição do hipoclorito de magnésio
O Mg(ClO)2 não tem ponto de ebulição definido porque se decompõe antes de atingir seu ponto de ebulição. Quando aquecido, o Mg(ClO)2 libera gás oxigênio, deixando o cloreto de magnésio como um resíduo sólido.
Ponto de fusão do hipoclorito de magnésio
O ponto de fusão do Mg(ClO)2 é 100°C. A esta temperatura, os cristais sólidos de Mg(ClO)2 transformam-se em líquido. Porém, devido à sua instabilidade em altas temperaturas, recomenda-se manuseá-lo com cuidado.
Densidade de hipoclorito de magnésio g/mL
A densidade do Mg(ClO)2 é 2,08 g/mL à temperatura ambiente. Isso significa que um mililitro de Mg(ClO)2 tem massa de 2,08 gramas.
Peso molecular do hipoclorito de magnésio
O peso molecular do Mg(ClO)2 é 127,21 g/mol. É a soma dos pesos atômicos de todos os elementos do composto, nomeadamente magnésio, cloro e oxigênio.
Estrutura do hipoclorito de magnésio
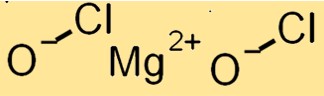
O Mg(ClO)2 possui uma estrutura cristalina com um sistema cristalino monoclínico. Consiste em cátions Mg+2 e ânions ClO, que são mantidos juntos por ligações iônicas. Os ânions ClO estão em um arranjo tetraédrico distorcido em torno dos cátions Mg+2.
Solubilidade do hipoclorito de magnésio
O Mg(ClO)2 é ligeiramente solúvel em água, com solubilidade de 14,6 g/100 mL a 20°C. Forma uma solução ligeiramente básica em água devido à hidrólise dos íons hipoclorito. No entanto, não é recomendado dissolver Mg(ClO)2 em água, pois pode produzir cloro gasoso, que é tóxico e pode ser prejudicial à saúde humana.
| Aparência | Sólido branco |
| Gravidade Específica | 2,08 g/mL a 20°C |
| Cor | Branco |
| Cheiro | Levemente clorado |
| Massa molar | 127,21 g/mol |
| Densidade | 2,08 g/mL a 20°C |
| Ponto de fusão | 100ºC |
| Ponto de ebulição | Decompõe-se antes de atingir o ponto de ebulição |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Ligeiramente solúvel (14,6 g/100 mL a 20°C) |
| Solubilidade | Ligeiramente solúvel em água, solúvel em ácidos |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Solução um pouco básica |
Segurança e perigos do hipoclorito de magnésio
O Mg(ClO)2 pode ser perigoso se não for manuseado corretamente. É um forte agente oxidante que pode reagir violentamente com certos produtos químicos. O contato com a pele, olhos e mucosas pode causar irritação e queimaduras. A inalação de poeira ou névoa pode causar problemas respiratórios. Também é importante evitar misturar Mg(ClO)2 com ácidos ou outros compostos que contenham cloro, pois isso pode produzir gás cloro tóxico. Recomenda-se usar equipamentos de proteção, como luvas e óculos de proteção, ao manusear Mg(ClO)2 e armazená-lo em local fresco e seco, longe de produtos químicos incompatíveis.
| Símbolos de perigo | Agente oxidante, prejudicial |
| Descrição de segurança | Manter afastado do calor, faíscas e chamas abertas. Não respire poeira ou névoa. Use luvas e óculos de proteção. |
| Números de identificação da ONU | Um 1748 |
| Código SH | 2828.10.10 |
| Classe de perigo | 5.1 (Agente oxidante), 6.1 (Tóxico) |
| Grupo de embalagem | II |
| Toxicidade | LD50 (oral, rato) – 290 mg/kg; CL50 (inalação, rato) – 2,07 mg/L/4h; Irritação cutânea – Leve; Irritação ocular – Grave |
Métodos de síntese de hipoclorito de magnésio
Para sintetizar Mg(ClO)2, o método mais comumente usado é reagir óxido de magnésio com cloro gasoso.
Num método, para produzir Mg(ClO)2, o óxido de magnésio deve ser misturado com cloro gasoso na presença de água. É necessário um controle cuidadoso durante a reação exotérmica para evitar a formação de subprodutos indesejados.
Outro método envolve a reação entre hidróxido de magnésio e ácido hipocloroso. Para manter o pH, a reação geralmente ocorre em solução de hidróxido de sódio. A solução resultante de Mg(ClO)2 pode ser separada por filtração e depois seca após a reação.
Um terceiro método envolve a reação entre carbonato de magnésio e ácido hipocloroso. Esta reação produz Mg(ClO)2 e dióxido de carbono. Para evitar a formação de subprodutos indesejados, é necessário monitorar cuidadosamente a reação.
Independentemente do método de síntese utilizado, é importante manusear o Mg(ClO)2 com cuidado devido às suas propriedades oxidantes e perigos potenciais.
Usos do hipoclorito de magnésio
O Mg(ClO)2 tem diversas aplicações práticas devido às suas propriedades oxidantes e à sua capacidade de liberar gás cloro. Aqui estão alguns usos comuns de Mg(ClO)2:
- Tratamento de Água: Comumente usado como desinfetante em estações de tratamento de água para matar bactérias e vírus nocivos.
- Alvejante: Usado como agente de branqueamento para têxteis, papel e outros materiais.
- Piscinas: Utilizado como agente sanitizante em piscinas para manter uma boa química da água.
- Controle de Odores: Usado para controlar odores desagradáveis em estações de tratamento de resíduos e sistemas de esgoto.
- Agente oxidante: utilizado como agente oxidante na produção de diversos produtos químicos, como epóxidos e cetonas.
- Agricultura: Utilizado na agricultura como desinfetante e pesticida para combater doenças fúngicas e bacterianas.
- Saneamento: Também utilizado como desinfetante para superfícies e equipamentos em hospitais, fábricas de processamento de alimentos e outras instalações.
Questões:
P: Qual é a fórmula do hipoclorito de magnésio?
R: A fórmula do hipoclorito de magnésio é Mg(ClO)2.
P: Qual é o nível de pH do hipoclorito de magnésio?
R: O nível de pH do Mg(ClO)2 depende de sua concentração e pode variar. No entanto, uma solução de Mg(ClO)2 geralmente tem um pH entre 8 e 10.
P: Qual é a fórmula molecular do hipoclorito de magnésio?
R: A fórmula molecular do hipoclorito de magnésio é Mg(ClO)2.
P: Qual é o nome de Mg(ClO)2?
R: O nome do Mg(ClO)2 é hipoclorito de magnésio.
P: O Mg(ClO)2 é um ácido ou uma base?
R: Mg(ClO)2 é um sal básico e pode atuar como uma base fraca em soluções aquosas.
P: O Mg(ClO)2 é um sal?
R: Sim, Mg(ClO)2 é sal. É um composto cristalino branco altamente solúvel em água e contém um metal (magnésio) e um não metal (cloro).
