O hipoclorito de cálcio (Ca(ClO)2) é um composto químico comumente usado como desinfetante e alvejante. É eficaz para matar bactérias, vírus e algas no tratamento de água e saneamento.
| Nome IUPAC | Hipoclorito de cálcio |
| Fórmula molecular | Ca(ClO)2 |
| Número CAS | 7778-54-3 |
| Sinônimos | Sal de cálcio de ácido hipocloroso, Pó descolorante, Cal clorada, Oxicloreto de cálcio, HTH, Cal hipo |
| InChI | InChI=1S/Ca.2ClO/c;2 1-2/q+2;2 -1 |
Propriedades do hipoclorito de cálcio
Fórmula de hipoclorito de cálcio
O hipoclorito de cálcio tem a fórmula química Ca(ClO)2. É um sólido cristalino branco que exala um forte odor de cloro. A fórmula do hipoclorito de cálcio mostra que ele contém um íon Ca+2 e dois íons ClO-. O íon hipoclorito tem carga negativa e é responsável pelas fortes propriedades oxidantes do composto.
Massa molar de hipoclorito de cálcio
A massa molar do Ca(ClO)2 é 142,98 g/mol. É calculado somando as massas atômicas de cálcio, cloro e oxigênio presentes em uma molécula de Ca(ClO)2. A massa molar do Ca(ClO)2 é um parâmetro importante utilizado em vários cálculos químicos.
Ponto de ebulição do hipoclorito de cálcio
Ca(ClO)2 se decompõe antes de atingir seu ponto de ebulição. Seu ponto de ebulição não está, portanto, bem definido. Quando o Ca(ClO)2 é aquecido, ele sofre decomposição térmica para formar cloreto de cálcio, oxigênio e cloro gasoso.
Ponto de fusão do hipoclorito de cálcio
O ponto de fusão do Ca(ClO)2 é 100°C. A esta temperatura, o Ca(ClO)2 derrete para formar um líquido transparente. O Ca(ClO)2 é muito solúvel em água e quando se dissolve na água libera íons hipoclorito, tornando-o um desinfetante eficaz.
Densidade de hipoclorito de cálcio g/mL
A densidade do Ca(ClO)2 é 2,35 g/mL. É um composto relativamente denso e mais pesado que a água. A alta densidade do Ca(ClO)2 se deve à presença de íons cálcio em sua rede cristalina.
Peso molecular do hipoclorito de cálcio
O peso molecular do Ca(ClO)2 é 142,98 g/mol. É calculado somando as massas atômicas de cálcio, cloro e oxigênio presentes em uma molécula de Ca(ClO)2. O peso molecular do Ca(ClO)2 é um parâmetro importante utilizado em vários cálculos químicos.
Estrutura do hipoclorito de cálcio
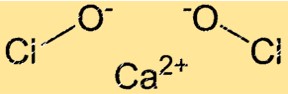
Ca(ClO)2 tem uma estrutura cristalina. A estrutura cristalina do Ca(ClO)2 é composta por íons Ca+2 e íons ClO-. Os íons ClO- estão dispostos em uma geometria tetraédrica em torno dos íons Ca+2. A estrutura cristalina do Ca(ClO)2 confere-lhe fortes propriedades oxidantes.
Solubilidade do hipoclorito de cálcio
Ca(ClO)2 é muito solúvel em água. Dissolve-se em água para formar um íon hipoclorito e um íon cálcio. A solubilidade do Ca(ClO)2 em água aumenta com o aumento da temperatura. Ca(ClO)2 também é solúvel em solventes orgânicos como acetona e etanol.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 2,35 |
| Cor | Branco |
| Cheiro | Cheiro de cloro |
| Massa molar | 142,98 g/mol |
| Densidade | 2,35g/cm³ |
| Ponto de fusão | 100ºC |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 21g/100ml (20ºC) |
| Solubilidade | Solúvel em acetona, etanol, glicerol e água |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | 7,5 |
| pH | ~11 |
Segurança e perigos do hipoclorito de cálcio
Ca(ClO)2 pode ser perigoso se não for manuseado corretamente. É um poderoso oxidante que pode reagir violentamente com compostos orgânicos, liberando gases tóxicos. Pode causar irritação na pele e nos olhos e a exposição prolongada pode causar problemas respiratórios. Deve ser armazenado em local fresco, seco e bem ventilado, longe de matéria orgânica, agentes redutores e ácidos. O Ca(ClO)2 deve ser manuseado com cuidado e equipamentos de proteção, como luvas e óculos de proteção, devem ser usados ao manuseá-lo. Não deve ser misturado com outros produtos químicos, incluindo ácidos ou agentes redutores, pois pode causar explosão.
| Símbolos de perigo | Ó, Xi, N |
| Descrição de segurança | Nocivo se ingerido, causa irritação na pele, causa irritação ocular grave, pode causar câncer |
| Números de identificação da ONU | ONU1748 |
| Código SH | 2828.90.00 |
| Classe de perigo | 5.1 (Agentes oxidantes) |
| Grupo de embalagem | II |
| Toxicidade | LD50 (oral, rato) = 850 mg/kg; CL50 (inalação, rato) = 10,8 mg/m³ (exposição de 4 horas) |
Métodos para a síntese de hipoclorito de cálcio
Existem vários métodos para sintetizar Ca(ClO)2.
Um método envolve a mistura de cloro gasoso com cal apagada, também conhecida como hidróxido de cálcio , em água. A reação produz Ca(ClO)2, cloreto de cálcio e água. Outro método envolve a reação do gás cloro com hidróxido de cálcio seco, resultando em Ca(ClO)2 e vapor d’água.
O processo de produção de Ca(ClO)2 em larga escala normalmente envolve a reação do hipoclorito de sódio com cloreto de cálcio , que gera Ca(ClO)2 e cloreto de sódio.
Outro método envolve a reação do carbonato de cálcio com cloro gasoso na presença de água ou ácido acético. A reação produz Ca(ClO)2, dióxido de carbono, água ou acetato de cálcio e ácido clorídrico.
Esses métodos requerem manuseio cuidadoso e equipamento apropriado para garantir segurança e eficácia. A escolha do método depende da escala de produção e da pureza desejada do produto final.
Usos do hipoclorito de cálcio
O Ca(ClO)2 tem uma ampla gama de utilizações devido às suas fortes propriedades oxidantes e desinfetantes. Aqui estão alguns usos comuns de Ca(ClO)2:
- Tratamento de água: amplamente utilizado para desinfetar água em piscinas, sistemas de água potável e estações de tratamento de águas residuais.
- Alvejante: Utilizado como agente branqueador para algodão, linho e pasta de papel, bem como na fabricação de papel e têxteis.
- Desinfecção: Comumente utilizado para desinfetar superfícies e equipamentos na indústria alimentícia.
- Desodorização: Utilizada para remover odores desagradáveis de tecidos, carpetes e outros materiais.
- Desinfetante: Desinfetante eficaz para hospitais, laboratórios e outros estabelecimentos de saúde.
- Controle de Algas: Usado para controlar o crescimento de algas em corpos d’água, como lagoas e lagos.
- Síntese química: Utilizado na síntese de diversos compostos orgânicos e inorgânicos.
- Uso doméstico: Utilizado como desinfetante doméstico, principalmente para limpar e desinfetar vasos sanitários e tubulações.
- Perfuração de poços de petróleo: Também usado na perfuração de poços de petróleo para prevenir o crescimento de bactérias e outros microorganismos.
Questões:
P: Você pode usar hipoclorito de cálcio para remover uma tatuagem?
R: Não, Ca(ClO)2 não deve ser usado para remover uma tatuagem. É um forte agente oxidante que pode causar sérios danos e cicatrizes na pele.
P: Como posso armazenar o hipoclorito de cálcio?
R: O Ca(ClO)2 deve ser armazenado em local fresco, seco e bem ventilado, longe da luz solar direta, fontes de calor e substâncias incompatíveis. Deve ser armazenado em recipiente bem fechado e protegido da umidade e água.
P: Onde comprar hipoclorito de cálcio?
R: O Ca(ClO)2 pode ser adquirido em empresas de fornecimento de produtos químicos, lojas de suprimentos para piscinas e varejistas on-line.
P: Quanto hipoclorito de cálcio para água potável?
R: A quantidade de Ca(ClO)2 necessária para o tratamento de água potável depende da concentração da solução e do volume de água a ser tratada. A dosagem recomendada é geralmente entre 0,2 e 0,5 ppm (partes por milhão) para desinfecção regular.
P: Quanto hipoclorito de cálcio é seguro para ingestão?
R: O Ca(ClO)2 nunca deve ser ingerido, pois é altamente tóxico e pode causar sérios problemas de saúde ou até a morte.
P: Purificação de água com hipoclorito de cálcio?
R: Ca(ClO)2 é comumente usado para purificação e desinfecção de água em uma variedade de ambientes, incluindo piscinas, sistemas de água potável e estações de tratamento de águas residuais.
P: Choque com hipoclorito de cálcio?
R: O choque de Ca(ClO)2 é um processo de adição de uma concentração mais alta de Ca(ClO)2 a uma piscina ou spa para aumentar rapidamente os níveis de cloro e eliminar bactérias e contaminantes nocivos.
P: Hipoclorito de cálcio para desinfetar água?
R: Ca(ClO)2 é um desinfetante poderoso frequentemente usado para tratamento e purificação de água para eliminar bactérias, vírus e outros microorganismos prejudiciais.
P: O Ca(OCl)2 é um ácido ou uma base?
R: O hipoclorito de cálcio (Ca(OCl)2) é uma base porque pode aceitar um próton para formar um íon hidróxido.
P: Que forma reduzida de Ca(OCl)2 permanece no final do experimento?
R: A forma reduzida de Ca(OCl)2 que permanece no final de um experimento depende da reação específica que ocorre. Em alguns casos pode ser cloreto de cálcio (CaCl2) ou carbonato de cálcio (CaCO3).
