Hidróxido de níquel (Ni(OH)2) é um composto químico composto de íons níquel e hidróxido. É comumente usado como precursor de baterias à base de níquel.
| Nome da IUPAC | Hidróxido de níquel |
| Fórmula molecular | Ni(OH)2 |
| Número CAS | 12054-48-7 |
| Sinônimos | Hidróxido de níquel(II); Hidróxido de níquel; Trióxido de Níquel Nitrogênio (2+) |
| InChI | InChI=1S/Ni.2H2O/h;2*1H2/q+2;;/p-2 |
Propriedades do hidróxido de níquel
Fórmula de hidróxido de níquel
A fórmula do hidróxido de níquel é Ni(OH)2. Consiste em um íon níquel (Ni) e dois íons hidróxido (OH-). Esta fórmula química representa a composição do hidróxido de níquel em nível atômico.
Massa molar de hidróxido de níquel
A massa molar do Ni(OH)2 é calculada somando as massas atômicas de seus elementos constituintes. O níquel tem massa atômica de 58,6934 g/mol e cada íon hidróxido tem massa de 17,007 g/mol. Somando-os, a massa molar do Ni(OH)2 é de aproximadamente 92,6934 g/mol.
Ponto de ebulição do hidróxido de níquel
Ni(OH)2 não tem ponto de ebulição bem definido porque se decompõe quando aquecido. Em altas temperaturas sofre decomposição térmica e se transforma em óxido de níquel (NiO) e vapor d’água.
Ponto de fusão do hidróxido de níquel
O ponto de fusão do Ni(OH)2 é aproximadamente 230°C. A esta temperatura, o Ni(OH)2 sofre uma mudança de fase do estado sólido para o estado líquido. O composto derrete, permitindo novas reações ou tratamentos químicos.
Densidade de hidróxido de níquel g/mL
A densidade do Ni(OH)2 é de aproximadamente 4,1 g/mL. Este valor representa a massa do composto por unidade de volume. Indica a compactação ou concentração de Ni(OH)2 em um determinado espaço.
Peso molecular do hidróxido de níquel
O peso molecular do Ni(OH)2 é determinado somando os pesos atômicos de seus elementos constituintes. O níquel tem peso atômico de 58,6934 g/mol e cada íon hidróxido pesa 17,007 g/mol. Assim, o peso molecular do Ni(OH)2 é de aproximadamente 92,6934 g/mol.
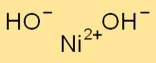
Estrutura do hidróxido de níquel
Ni(OH)2 cristaliza no sistema cristalino hexagonal. Forma camadas de íons Ni+2 e OH- empilhados uns sobre os outros. Os íons Ni+2 são cercados por íons OH- de maneira coordenada, criando uma estrutura de rede.
Solubilidade do hidróxido de níquel
Ni(OH)2 é pouco solúvel em água. Dissolve-se até certo ponto, formando uma solução ligeiramente alcalina devido à presença de íons hidróxido. A solubilidade do Ni(OH)2 pode ser influenciada por fatores como temperatura e pH.
| Aparência | Verde sólido |
| Gravidade Específica | 4,1 g/ml |
| Cor | Verde |
| Cheiro | Inodoro |
| Massa molar | 92,6934 g/mol |
| Densidade | 4,1 g/ml |
| Ponto de fusão | 230ºC |
| Ponto de ebulição | Decomposto |
| Ponto flash | N / D |
| Solubilidade em Água | Ligeiramente solúvel |
| Solubilidade | Insolúvel, forma uma solução alcalina em água |
| Pressão de vapor | N / D |
| Densidade do vapor | N / D |
| pKa | N / D |
| pH | Alcalino |
Segurança e perigos do hidróxido de níquel
Ni(OH)2 apresenta certos riscos de segurança que devem ser considerados. Pode irritar a pele, os olhos e o sistema respiratório por contato ou inalação. A exposição prolongada ou repetida pode levar à sensibilização, causando reações alérgicas. É importante manusear o Ni(OH)2 com cuidado, utilizando medidas de proteção adequadas, como luvas, óculos de proteção e respirador. Se ocorrer ingestão ou exposição acidental, deve-se procurar atendimento médico imediato. Além disso, o Ni(OH)2 é considerado um perigo ambiental e deve ser descartado adequadamente de acordo com os regulamentos para evitar a contaminação do solo ou de fontes de água.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | – Pode causar irritação na pele e nos olhos\n- Pode causar irritação respiratória\n- Possível sensibilização\n- Siga os procedimentos adequados de manuseio e descarte |
| Números de identificação da ONU | Não aplicável |
| Código SH | 2825.70.10 |
| Classe de perigo | Não classificado como perigoso |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Considerada toxicidade baixa a moderada |
Tenha em atenção que os símbolos de perigo e os identificadores da ONU não se aplicam ao Ni(OH)2, uma vez que não é classificado como uma substância perigosa. A descrição de segurança fornecida destaca os riscos e precauções potenciais associados ao manuseio do Ni(OH)2. A toxicidade do Ni(OH)2 é geralmente considerada baixa a moderada.
Métodos de síntese de hidróxido de níquel
Existem vários métodos sintéticos disponíveis para a produção de Ni(OH)2. Um método comum envolve a reação entre um sal solúvel de níquel, como sulfato de níquel ou nitrato de níquel, e um hidróxido alcalino, geralmente hidróxido de sódio ou hidróxido de potássio. A reação ocorre em solução aquosa sob condições controladas, resultando na formação de Ni(OH)2 como precipitado.
No método de deposição eletroquímica, a célula eletrolítica utiliza níquel metálico como eletrodo. Aplica uma corrente elétrica apropriada para reduzir os íons de níquel do eletrólito e depositá-los no eletrodo na forma de Ni(OH)2. Este método permite o controle preciso da composição e morfologia do Ni(OH)2 resultante.
A decomposição térmica dos sais de níquel permite a produção de Ni(OH)2. Ao aquecer um sal de níquel, como o carbonato de níquel ou o próprio Ni(OH)2, em um ambiente controlado, o composto sofre decomposição, produzindo Ni(OH)2 e outros subprodutos.
Vale ressaltar que a escolha do método de síntese depende de fatores como pureza desejada, tamanho de partícula e requisitos específicos da aplicação. Ao selecionar a rota sintética apropriada para a produção de Ni(OH)2, deve-se considerar cuidadosamente o resultado desejado devido às vantagens e limitações associadas a cada método.
Usos do hidróxido de níquel
Ni(OH)2 encontra diversas aplicações devido às suas propriedades únicas. Aqui estão alguns usos comuns de Ni(OH)2:
- Fabricação de baterias: Ni(OH)2 desempenha um papel crucial como material catódico em baterias à base de níquel, como baterias de níquel-cádmio (NiCd) e níquel-hidreto metálico (NiMH). Ele armazena e libera energia elétrica, permitindo um armazenamento eficiente de energia.
- Catalisador: Ni(OH)2 atua como catalisador em diversas reações químicas, incluindo processos de hidrogenação e oxidação. Suas propriedades catalíticas facilitam a conversão eficiente de reagentes em produtos desejados.
- Galvanoplastia: Ni(OH)2 forma uma camada de níquel estável e aderente, tornando-o valioso em aplicações de galvanoplastia. Fornece um revestimento protetor, resistente à corrosão e esteticamente atraente em diversas superfícies metálicas.
- Pigmentos: Os fabricantes utilizam Ni(OH)2 como pigmento verde na produção de cerâmica, vidro e plásticos. A sua cor verde vibrante realça o valor estético destes materiais.
- Sensores de gás: Sensores baseados em Ni(OH)2 detectam e monitoram gases como hidrogênio, amônia e sulfeto de hidrogênio. Mudanças na condutividade elétrica em filmes de Ni(OH)2 permitem a detecção eficiente desses gases.
- Tratamento de Água: Ni(OH)2 auxilia nos processos de tratamento de água adsorvendo e removendo seletivamente contaminantes de metais pesados, como chumbo e cádmio. Apresenta afinidade por esses metais, o que o torna útil para sua remoção de fontes de água.
- Aplicações farmacêuticas: Ni(OH)2 encontra aplicação em formulações farmacêuticas, servindo como aglutinante, desintegrante ou regulador de pH em formulações de comprimidos ou cápsulas.
Estes são apenas alguns exemplos das diversas aplicações do Ni(OH)2, demonstrando sua versatilidade e importância em diversas indústrias.
Questões:
P: Qual é a fórmula química do hidróxido básico de níquel (II)?
R: A fórmula química do hidróxido de níquel (II) é Ni (OH)2.
P: O hidróxido de níquel é solúvel em água?
R: Ni(OH)2 é insolúvel em água.
P: Quantos gramas de cloreto de níquel (II) são necessários para neutralizar 75,0 ml de hidróxido de lítio 0,555 M?
R: Os gramas de cloreto de níquel necessários podem ser calculados usando a estequiometria e a molaridade da solução de hidróxido de lítio.
P: Que carga representa o Ni(OH)2?
R: A carga de Ni(OH)2 é neutra ou zero.
P: Como calcular a solubilidade molar do Ni(OH)2?
R: A solubilidade molar do Ni(OH)2 pode ser determinada dividindo o número de moles do composto dissolvido pelo volume da solução.
P: Qual é a forma balanceada da equação NaOH(aq) + NiCl2(aq) → NaCl(aq) + Ni(OH)2(s)?
R: A equação balanceada é 2NaOH(aq) + NiCl2(aq) → 2NaCl(aq) + Ni(OH)2(s).
P: Quantos gramas por mol equivalem a Ni(OH)2?
R: A massa molar do Ni(OH)2 é aproximadamente 92,6934 g/mol.
P: O Ni(OH)2 é solúvel em água?
R: Não, Ni(OH)2 é insolúvel em água.
P: Qual é o agente redutor na reação: Mg + NiO2 + 2H2O → Mg(OH)2 + Ni(OH)2?
R: O agente redutor na reação é o magnésio (Mg).
P: O Ni(OH)2 é um sólido?
R: Sim, Ni(OH)2 é um composto sólido.
P: Se a célula tem um potencial de 0,247 V a 25°C, qual é o Ksp do Ni(OH)2?
R: O Ksp do Ni(OH)2 pode ser determinado usando a equação de Nernst e o potencial celular.
P: Quais sais serão mais solúveis em solução ácida do que em água pura?
R: Sais como Ni(OH)2 serão mais solúveis em uma solução ácida devido à reação de neutralização com o ácido.
