Hidróxido de magnésio (Mg(OH)2) é um antiácido e laxante usado para tratar azia, indigestão e prisão de ventre. Ele atua neutralizando o ácido estomacal e atraindo água para o cólon para promover a evacuação.
| Nome IUPAC | Hidróxido de magnésio |
| Fórmula molecular | Mg(OH)2 |
| Número CAS | 1309-42-8 |
| Sinônimos | Leite de magnésia; Brucita; Dihidróxido de magnésio; Hidromagnesita; Magnésia Branca |
| InChI | InChI=1S/2H2O.Mg/h2*1H2;/q;;+2/p-2 |
Propriedades do hidróxido de magnésio
Fórmula de Hidróxido de Magnésio
A fórmula química do hidróxido de magnésio é Mg(OH)2. Esta fórmula indica que um átomo de magnésio está ligado a dois íons hidróxido. A fórmula do hidróxido de magnésio é usada para calcular a massa molar, densidade e outras propriedades físicas da substância. A fórmula também fornece informações sobre a estrutura da substância, pois indica o número e os tipos de átomos presentes em uma molécula de hidróxido de magnésio.
Massa molar de hidróxido de magnésio
A massa molar de Mg(OH)2 é 58,32 g/mol. Esta é a massa de um mol de Mg(OH)2, que contém um mol de átomos de Mg e dois mols de íons OH-. A massa molar é um conceito importante em química porque é usada para calcular a quantidade de substância em uma determinada amostra.
Ponto de ebulição do hidróxido de magnésio
O Mg(OH)2 não tem um ponto de ebulição distinto porque se decompõe antes de atingir o seu ponto de ebulição. A temperatura de decomposição do Mg(OH)2 é de aproximadamente 350°C. Quando aquecido, o Mg(OH)2 se decompõe para formar óxido de magnésio e água.
Ponto de fusão do hidróxido de magnésio
O ponto de fusão do Mg(OH)2 é 350°C. A esta temperatura, o Mg(OH)2 sólido muda para o estado líquido. Este processo é conhecido como fusão. O ponto de fusão é uma propriedade física importante de uma substância porque determina a temperatura na qual um sólido se transforma em líquido.
Densidade de hidróxido de magnésio g/mL
A densidade do Mg(OH)2 é de aproximadamente 2,36 g/mL. A densidade é definida como a massa de uma substância por unidade de volume. Mg(OH)2 é uma substância relativamente densa devido à sua alta massa molar e à presença de dois íons OH- por átomo de Mg.
Peso molecular do hidróxido de magnésio
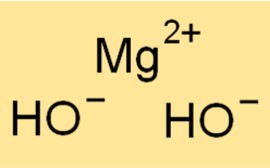
O peso molecular do Mg(OH)2 é 58,32 g/mol. É a soma dos pesos atômicos de todos os átomos de uma molécula de Mg(OH)2. O peso molecular é um conceito útil em química porque é usado para determinar a quantidade de uma substância em uma determinada amostra.
Estrutura do hidróxido de magnésio
Mg(OH)2 tem uma estrutura em camadas composta por íons Mg2+ e íons OH-. Os íons Mg2+ são cercados por seis íons OH-, e os íons OH- estão dispostos em uma estrutura hexagonal compacta. A estrutura em camadas do Mg(OH)2 dá origem às suas propriedades características, como a sua baixa solubilidade em água e a sua capacidade de formar uma suspensão em água.
| Aparência | Pó branco ou suspensão |
| Gravidade Específica | 2,36 g/ml |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 58,32 g/mol |
| Densidade | 2,36 g/ml |
| Ponto de fusão | 350ºC |
| Ponto de ebulição | Decompõe-se a 350°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 12 mg/L a 20°C |
| Solubilidade | Insolúvel em etanol e éter |
| Pressão de vapor | Insignificante |
| Densidade do vapor | Não aplicável |
| pKa | 10.4 |
| pH | 10,5 |
Segurança e perigos do hidróxido de magnésio
O Mg(OH)2 é geralmente considerado seguro de manusear e usar, com baixa toxicidade e sem efeitos cancerígenos conhecidos. No entanto, a exposição prolongada ao pó ou pó de Mg(OH)2 pode causar irritação respiratória e danos nos pulmões. O Mg(OH)2 também pode causar irritação ou corrosão dos olhos, pele e membranas mucosas em contato. É importante seguir as precauções de segurança adequadas ao manusear o Mg(OH)2, como usar equipamento de proteção e trabalhar em uma área bem ventilada. Em caso de contato ou exposição, procure atendimento médico e lave abundantemente as áreas afetadas com água.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | – Evite inalação e contato com olhos, pele e roupas. – Use roupas de proteção, luvas e proteção para os olhos/face. – Usar em uma área bem ventilada. |
| Números de identificação da ONU | Não regulamentado |
| Código SH | 2826.90.90 |
| Classe de perigo | Não classificado |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Baixa toxicidade; a exposição prolongada pode causar irritação respiratória e danos nos pulmões. |
Métodos de síntese de hidróxido de magnésio
Vários métodos podem sintetizar Mg(OH)2, como precipitação, síntese hidrotérmica e deposição eletroquímica.
O método de precipitação envolve a reação de hidróxido de sódio ou hidróxido de amônio com cloreto de magnésio ou sulfato de magnésio para formar Mg(OH)2. A reação produz Mg(OH)2, que alguém pode coletar e secar.
Para realizar a síntese hidrotérmica, deve-se aquecer a água a alta pressão e temperatura enquanto se adiciona óxido de magnésio ou carbonato de magnésio . O processo produzirá Mg(OH)2 e você poderá coletar os cristais resfriando a solução resultante.
A deposição eletroquímica envolve a passagem de uma corrente elétrica através de uma solução de íons de magnésio, fazendo com que eles reajam com íons hidróxido e formem Mg(OH)2 no cátodo.
Outros métodos de síntese de Mg(OH)2 incluem o uso de óxido de magnésio e leite de cal e a decomposição térmica de bicarbonato de magnésio.
Cada método tem suas vantagens e desvantagens em termos de eficácia, eficiência e custo. A escolha do método de síntese depende da aplicação específica e das propriedades desejadas do produto Mg(OH)2.
Usos do hidróxido de magnésio
O Mg(OH)2 tem uma ampla gama de aplicações em diversas indústrias, incluindo:
- Antiácido: comumente usado como antiácido para neutralizar o ácido estomacal e aliviar azia, indigestão e outros desconfortos digestivos.
- Retardador de Chama: Um retardador de chama não tóxico usado em plásticos, borracha e têxteis para reduzir o risco de incêndio.
- Ajuste de pH: Utilizado para ajustar o pH de diversos produtos, incluindo soluções de tratamento de água, cosméticos e farmacêuticos.
- Remediação Ambiental: Utilizada no tratamento de águas residuais e drenagem ácida de minas para neutralizar condições ácidas e remover metais pesados.
- Fertilizante: Usado como fertilizante para fornecer magnésio às plantas e melhorar o pH do solo.
- Aplicações Médicas: Usado como laxante e em alguns procedimentos médicos, como colonoscopias, para limpar o intestino.
- Outras aplicações: Utilizado como estabilizador em tintas látex, como agente branqueador em papel e como agente de polimento em vidro e cerâmica.
Questões:
P: Qual é a base usada na pasta de dente?
R: O Mg(OH)2 é comumente usado como base em cremes dentais para ajudar a neutralizar as condições ácidas da boca e reduzir o risco de cárie dentária.
P: Qual é a fórmula do hidróxido de magnésio?
R: A fórmula química do hidróxido de magnésio é Mg(OH)2.
P: Qual equação química mostra a dissociação do hidróxido de magnésio?
A: A equação química para a dissociação de Mg(OH)2 é
Mg(OH)2 → Mg2+ + 2OH-.
P: O hidróxido de magnésio é solúvel em água?
R: O Mg(OH)2 é pouco solúvel em água, o que significa que se dissolve de forma muito limitada.
P: Qual das seguintes substâncias é um ácido de Arrhenius? BF3, HCN, NH3, Mg(OH)2?
R: Nenhuma das substâncias listadas são ácidos de Arrhenius. BF3 e HCN são ácidos de Lewis, NH3 é uma base fraca de Arrhenius e Mg(OH)2 é uma base forte de Arrhenius.
P: O Mg(OH)2 é solúvel em água?
R: O Mg(OH)2 é pouco solúvel em água, o que significa que se dissolve de forma muito limitada.
P: Qual é a massa molar do Mg(OH)2?
R: A massa molar de Mg(OH)2 é aproximadamente 58,32 g/mol.
P: O Mg(OH)2 é um ácido ou uma base?
R: Mg(OH)2 é uma base porque é capaz de aceitar íons de hidrogênio (prótons) para formar água e um sal.
