O hidróxido de cobre (Cu(OH)2) é um sólido azul formado pela reação de sais de cobre com íons hidróxido. É utilizado como fungicida e em diversos processos químicos.
| Nome IUPAC | Hidróxido de cobre (II) |
| Fórmula molecular | Cu(OH)2 |
| Número CAS | 20427-59-2 |
| Sinônimos | Hidróxido de cobre; Dihidróxido de cobre; CuOH2 |
| InChI | InChI=1S/Cu.2H2O/h;2*1H2/q+2;;/p-2 |
Propriedades do hidróxido de cobre
Fórmula de hidróxido de cobre
A fórmula química do hidróxido cúprico é Cu(OH)2. Representa a combinação de um íon cobre (Cu2+) e dois íons OH mantidos juntos por ligações iônicas. Este composto sólido azul é comumente usado em diversas indústrias devido às suas propriedades únicas.
Massa molar de hidróxido de cobre
A massa molar do hidróxido cúprico (Cu(OH)2) pode ser calculada somando as massas atômicas de seus elementos constituintes. O cobre (Cu) tem massa atômica de aproximadamente 63,55 g/mol e cada íon OH- tem massa atômica combinada de aproximadamente 17,01 g/mol. A massa molar do hidróxido cúprico é, portanto, aproximadamente 97,55 g/mol.
Ponto de ebulição do hidróxido de cobre
O hidróxido de cobre não tem um ponto de ebulição distinto porque se decompõe antes de atingir o seu ponto de ebulição. Quando aquecido, sofre uma reação de decomposição térmica para formar óxido de cobre e vapor d’água.
Ponto de fusão do hidróxido de cobre
O hidróxido de cobre tem um ponto de fusão de aproximadamente 200°C (392°F). Nessa temperatura, o sólido passa por uma transição de fase e se transforma em estado líquido.
Densidade de hidróxido de cobre g/mL
A densidade do hidróxido cúprico é de aproximadamente 3,36 g/mL. Este valor representa a massa de um mililitro de hidróxido cúprico, indicando sua compactação e concentração.
Peso molecular do hidróxido de cobre
O peso molecular do hidróxido cúprico é de aproximadamente 97,55 g/mol. É calculado somando os pesos atômicos de todos os átomos presentes em uma molécula de hidróxido cúprico.
Estrutura do hidróxido de cobre
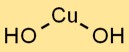
O hidróxido cúprico adota uma estrutura cristalina, com íons Cu2+ rodeados por íons OH- em um arranjo trigonal planar. Este arranjo de rede cristalina contribui para sua estabilidade e propriedades distintas.
Solubilidade do hidróxido de cobre
O hidróxido cúprico tem solubilidade limitada em água. Forma uma suspensão pouco solúvel em água, o que significa que apenas uma pequena quantidade do composto se dissolve no solvente. A solubilidade pode ser influenciada por fatores como temperatura e pH.
| Aparência | Azul Sólido |
| Gravidade Específica | ~3,36g/mL |
| Cor | Azul |
| Cheiro | Inodoro |
| Massa molar | ~97,55 g/mol |
| Densidade | ~3,36g/mL |
| Ponto de fusão | ~200°C (392°F) |
| Ponto de ebulição | Decomposto |
| Ponto flash | N / D |
| Solubilidade em Água | Pouco solúvel |
| Solubilidade | Limitado, varia com os níveis de temperatura e pH |
| Pressão de vapor | N / D |
| Densidade do vapor | N / D |
| pKa | N / D |
| pH | Alcalino (básico) |
Segurança e perigos do hidróxido de cobre
O hidróxido de cobre apresenta certas considerações de segurança e perigo. Geralmente é considerado de baixa toxicidade, mas pode causar irritação na pele, olhos e trato respiratório por contato ou inalação. Medidas de proteção adequadas, como uso de luvas e óculos de segurança, devem ser tomadas ao manusear este composto. Se ocorrer ingestão ou exposição acidental, é necessária atenção médica imediata. Além disso, o hidróxido de cobre deve ser armazenado em uma área segura e bem ventilada, longe de substâncias incompatíveis. Procedimentos adequados de descarte devem ser seguidos para evitar a contaminação do meio ambiente. Seguir as precauções de segurança é crucial para minimizar os riscos potenciais associados ao hidróxido de cobre.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Baixa toxicidade; Irritante |
| Números de identificação da ONU | Não aplicável |
| Código SH | 2825.90.5000 |
| Classe de perigo | Não classificado como perigoso |
| Grupo de embalagem | Não classificado |
| Toxicidade | Fraco |
Métodos de síntese de hidróxido de cobre
Existem vários métodos ativos para sintetizar hidróxido cúprico.
Uma abordagem comum envolve a reação de um sal de Cu, como CuSO4 , com uma base forte como hidróxido de sódio (NaOH) ou hidróxido de potássio (KOH) . Durante este processo, os íons hidróxido (OH-) da base deslocam os íons sulfato (SO4^2-) no CuSO4 , formando hidróxido cúprico (Cu(OH)2) como um precipitado azul.
Outro método envolve a reação de um sal de cobre (II) com amônia (NH3). Ao adicionar amônia a uma solução de Cu(II), o hidróxido cúprico precipita devido à combinação dos íons Cu2+ com os íons hidróxido da amônia.
A eletrólise permite a síntese de hidróxido cúprico pela imersão de um eletrodo de Cu em uma solução eletrolítica e pela aplicação de corrente elétrica direta. A redução da água no cátodo gera íons hidróxido, levando à formação de hidróxido cúprico.
Esses métodos de síntese ativa fornecem meios controlados e eficientes de produção de hidróxido cúprico para diversas aplicações industriais e de pesquisa.
Usos do hidróxido de cobre
O hidróxido de cobre encontra múltiplas aplicações em diversas indústrias devido às suas propriedades únicas e natureza versátil. Alguns usos notáveis incluem:
- Fungicida: Os agricultores utilizam-no amplamente como fungicida protetor para controlar doenças fúngicas em culturas como frutas, vegetais e plantas ornamentais.
- Intermediários Químicos: Serve como um intermediário químico valioso na síntese de vários compostos de cobre, como óxido de cobre e sais de cobre.
- Preservante de madeira: trata a madeira e oferece proteção contra insetos comedores de madeira e fungos causadores de podridão, prolongando assim a vida útil das estruturas de madeira.
- Agente antibacteriano: Em algumas formulações, atua como agente antibacteriano, encontrando aplicações em ambientes médicos e de saúde.
- Tratamento Aquático: Auxilia no manejo de algas e ervas daninhas aquáticas em lagoas, lagos e outros corpos d’água, mantendo o equilíbrio ecológico.
- Indústria de cerâmica e vidro: Os fabricantes o utilizam como corante para conferir tons vibrantes de azul e verde aos produtos de cerâmica e vidro.
- Pirotecnia: Contribui para a coloração de fogos de artifício e sinalizadores, desempenhando papel em aplicações pirotécnicas.
- Fabricação de baterias: Encontra sua utilização na produção de baterias como material de eletrodo, facilitando o armazenamento de energia.
- Tintas e Revestimentos: Algumas formulações de tintas incorporam-no para conferir propriedades protetoras e antimicrobianas.
A diversidade de aplicações destaca a importância do hidróxido de cobre em diversas indústrias, tornando-o um composto valioso para diversos usos práticos.
Questões:
P: O hidróxido de cobre é solúvel?
R: O hidróxido cúprico tem solubilidade limitada em água, formando uma suspensão pouco solúvel.
P: Quantos moles existem em 68 gramas de hidróxido de cobre (II) Cu (OH) 2?
R: Existem aproximadamente 0,697 moles de Cu(OH)2 em 68 gramas.
P: O hidróxido de cobre II é solúvel em água?
R: O hidróxido cúprico II tem solubilidade limitada em água.
P: O hidróxido de sódio e o sulfato de cobre são uma reação química?
R: Sim, a reação entre NaOH e CuSO4 resulta na formação de hidróxido cúprico e sulfato de sódio.
P: O hidróxido de cobre (II) é solúvel?
R: O hidróxido de cobre (II) tem solubilidade limitada em água.
P: Qual é a cor do hidróxido de cobre?
R: O hidróxido cúprico é de cor azul.
P: O hidróxido de cobre é um álcali?
R: O hidróxido de cobre é uma base, mas não é classificado como álcali.
P: O hidróxido de cobre é uma base forte?
R: O hidróxido de cobre não é considerado uma base forte.
P: O Cu(OH)2 é solúvel em água?
R: Cu(OH)2 tem solubilidade limitada em água.
P: Quantos moles existem em 68 gramas de hidróxido de cobre (II) Cu (OH) 2?
R: Existem aproximadamente 0,697 moles de Cu(OH)2 em 68 gramas.
P: Quantos mols existem em 34 gramas de Cu(OH)2?
R: Existem aproximadamente 0,3485 moles de Cu(OH)2 em 34 gramas.
P: Um Cu(OH)2 sólido se forma quando 0,075 g de KOH são dissolvidos em 1,0 L de Cu(NO3)2 a 1,0 × 10^−3 M?
R: Sim, o Cu(OH)2 sólido se forma como um precipitado devido à reação entre KOH e Cu(NO3)2.
