O hidróxido de cálcio (Ca(OH)2) é um composto químico utilizado em diversas aplicações, como produção de alimentos, tratamento de água e construção. É feito pela mistura de óxido de cálcio com água e tem aparência branca e pulverulenta.
| Nome da IUPAC | Hidróxido de cálcio |
| Fórmula molecular | Ca(OH)2 |
| Número CAS | 1305-62-0 |
| Sinônimos | Cal apagada, cal hidratada, leite de lima, lima em conserva |
| InChI | InChI=1S/Ca.2H2O/h;2*1H2/q+2;;/p-2 |
Propriedades do hidróxido de cálcio
Fórmula de Hidróxido de Cálcio
A fórmula química do hidróxido de cálcio é Ca(OH)2. Isso significa que cada molécula de hidróxido de cálcio contém um íon Ca2+ e dois íons OH-. A fórmula é importante em química porque representa o número e os tipos de átomos de um composto.
Massa molar de hidróxido de cálcio
Ca(OH)2 tem massa molar de 74,09 g/mol. É composto por um átomo de cálcio, dois átomos de oxigênio e dois átomos de hidrogênio. A massa molar é uma propriedade importante em química porque é usada para calcular a quantidade de uma substância em uma determinada amostra.
Ponto de ebulição do hidróxido de cálcio
Ca(OH)2 tem um ponto de ebulição muito alto de 2400°C. Isso significa que é necessária uma quantidade significativa de calor para transformá-lo de líquido em gás. O alto ponto de ebulição é devido às fortes ligações iônicas entre os íons cálcio e hidróxido.
Ponto de fusão do hidróxido de cálcio
Ca(OH)2 tem um ponto de fusão relativamente baixo de 580°C. Isso significa que pode ser facilmente derretido e moldado em diferentes formatos. O baixo ponto de fusão se deve à natureza iônica do composto, que permite que os íons se movam mais livremente quando aquecidos.
Densidade de hidróxido de cálcio g/mL
A densidade do Ca(OH)2 é 2,24 g/mL. Isso significa que é um composto relativamente pesado, comparado à água que tem densidade de 1 g/mL. A alta densidade se deve à natureza muito compacta dos íons Ca2+ e OH-.
Peso molecular do hidróxido de cálcio
O peso molecular do Ca(OH)2 é 74,09 g/mol. Esta é a soma dos pesos atômicos dos átomos de cálcio, oxigênio e hidrogênio no composto. O peso molecular é uma propriedade importante em química, pois é utilizado para calcular diversos parâmetros como molaridade e porcentagem de composição.
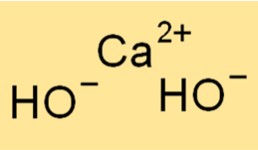
Estrutura do hidróxido de cálcio
O Ca(OH)2 possui uma estrutura cristalina, com cada íon cálcio rodeado por seis íons hidróxido em um arranjo octaédrico. Esta estrutura confere ao composto a sua característica aparência branca e pulverulenta. As ligações iônicas entre os íons Ca2+ e OH- são fortes, conferindo ao composto seus altos pontos de fusão e ebulição.
| Aparência | pó branco |
| Gravidade Específica | 2,24g/cm³ |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 74,09 g/mol |
| Densidade | 2,24g/cm³ |
| Ponto de fusão | 580°C |
| Ponto de ebulição | 2.400°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 1,7g/L (20°C) |
| Solubilidade | Solúvel em ácidos |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | 12,5 (primeira dissociação) |
| pH | 12,5 (solução 0,1 M, 25°C) |
Segurança e perigos do hidróxido de cálcio
Ca(OH)2 é geralmente considerado seguro quando manuseado corretamente. No entanto, pode ser prejudicial se ingerido, inalado ou se entrar em contacto com a pele ou os olhos. Isso pode causar irritação, queimaduras e problemas respiratórios. A poeira do composto também pode irritar o sistema respiratório. Equipamentos de proteção como luvas, óculos de proteção e respiradores devem ser usados ao manusear Ca(OH)2. O composto também deve ser armazenado em local fresco, seco e bem ventilado, longe de materiais incompatíveis. Em caso de contato ou ingestão, procure imediatamente atendimento médico.
| Símbolos de perigo | Xi (irritante) |
| Descrição de segurança | Use luvas de proteção e proteção para os olhos/face. |
| Números de identificação da ONU | Um 1910 |
| Código SH | 2825.90.90 |
| Classe de perigo | 8 – Substâncias corrosivas |
| Grupo de embalagem | III |
| Toxicidade | O hidróxido de cálcio é geralmente considerado não tóxico quando manuseado corretamente. No entanto, a ingestão ou inalação pode irritar e queimar o sistema respiratório e o trato digestivo. |
Métodos para a síntese de hidróxido de cálcio
Vários métodos podem sintetizar Ca(OH)2.
Um método comum para sintetizar Ca(OH)2 é reagir água com óxido de cálcio , resultando na formação de cal apagada ou cal hidratada.
Outro método envolve a reação do cloreto de cálcio com hidróxido de sódio. A reação da água e do dióxido de carbono com o carbonato de cálcio produz Ca(OH)2.
O processo de hidratação envolve a mistura de água com óxido de cálcio pelo método da cal apagada. Esta reação produz Ca(OH)2 e calor como subproduto. O processo remove ainda mais impurezas e excesso de água da pasta resultante.
O método do cloreto de cálcio envolve a mistura de cloreto de cálcio e hidróxido de sódio em um processo denominado decomposição dupla.
Esta reação produz Ca(OH)2 e cloreto de sódio como subprodutos. O Ca(OH)2 resultante é então purificado e seco.
No método do carbonato de cálcio, o carbonato de cálcio é primeiro aquecido para produzir óxido de cálcio e dióxido de carbono. O processo de hidratação envolve a mistura de óxido de cálcio com água, que produz Ca(OH)2.
Usos do hidróxido de cálcio
Ca(OH)2 tem muitos usos em diversas indústrias, incluindo:
- Construção: Utilizado como componente chave na produção de concreto, argamassa e estuque devido à sua capacidade de fortalecer e aumentar a durabilidade desses materiais.
- Agricultura: Usado como corretivo do solo para reduzir a acidez do solo e melhorar a fertilidade do solo.
- Tratamento de Água: Usado para amaciar a água, removendo impurezas como íons de magnésio e cálcio.
- Fabricação de produtos químicos: utilizada na produção de diversos produtos químicos, como estearato de cálcio, hipoclorito de cálcio e fosfato de cálcio.
- Indústria alimentícia: utilizado como aditivo alimentar para regular os níveis de acidez em produtos alimentícios como picles, azeitonas e refrigerantes.
- Indústria Médica: Utilizado em diversos procedimentos odontológicos, como tratamentos de canal radicular e obturações de cavidades, devido às suas propriedades antimicrobianas e antifúngicas.
- Indústria de Papel e Celulose: Usado na produção de papel para melhorar o brilho e a resistência do papel.
- Indústria do couro: Utilizado no processamento de couro para remover pelos e impurezas.
Questões:
P: O hidróxido de cálcio é solúvel?
R: Ca(OH)2 é moderadamente solúvel em água, com solubilidade de aproximadamente 1,2 g/L à temperatura ambiente.
P: Qual é a fórmula do hidróxido de cálcio?
R: A fórmula do hidróxido de cálcio é Ca(OH)2.
P: Onde comprar hidróxido de cálcio perto de mim?
R: O Ca(OH)2 pode ser adquirido em lojas de produtos químicos, lojas de ferragens ou varejistas online. Você pode pesquisar lojas de produtos químicos ou de ferragens perto de sua área ou verificar varejistas on-line, como Amazon ou eBay.
P: O Ca(OH)2 é um ácido ou uma base?
R: Ca(OH)2 é uma base. É uma base forte que se dissocia completamente em água para formar íons cálcio (Ca2+) e íons hidróxido (OH-).
P: Quando ocorre a reação H3PO4(aq)+Ca(OH)2(aq)→, qual é a fórmula do sal formado?
R: A reação entre H3PO4(aq) e Ca(OH)2(aq) produz fosfato de cálcio (Ca3(PO4)2) e água (H2O) como sal e subproduto, respectivamente.
P: O Ca(OH)2 é solúvel em água?
R: Sim, Ca(OH)2 é moderadamente solúvel em água. Pode dissolver-se em água para formar uma solução saturada com concentração de aproximadamente 1,2 g/L à temperatura ambiente.
P: O Ca(OH)2 é uma base forte?
R: Sim, Ca(OH)2 é uma base forte. É um composto altamente básico que se dissocia completamente em água para formar íons Ca2+ e OH-, tornando-o uma base forte.
P: Quais são produzidos quando o HCl reage com Ca(OH)2?
R: Quando o HCl reage com Ca(OH)2, os produtos formados são cloreto de cálcio (CaCl2) e água (H2O), porque os íons H+ do HCl reagem com os íons OH- do Ca(OH)2 para formar água, enquanto os íons Ca2+ e Cl- restantes formam o sal cloreto de cálcio.
