A hidrazina ou N2H4 é um composto incolor e altamente reativo composto de nitrogênio e hidrogênio. É usado como propulsor de foguetes, em produtos farmacêuticos e químicos agrícolas, e como agente redutor em reações químicas.
| Nome IUPAC | Hidrazina |
| Fórmula molecular | N2H4 |
| Número CAS | 302-01-2 |
| Sinônimos | Diamina; Diazano; Hidreto de nitrogênio; Hidrazina anidra; Hidrazina anidra; Hidróxido de hidrazinio; Hidrazina hidratada; Metilhidrazina; Hidrazina simétrica |
| InChI | InChI=1S/H4N2/c1-2/h2H,1H2 |
Estrutura de Lewis N2H4:
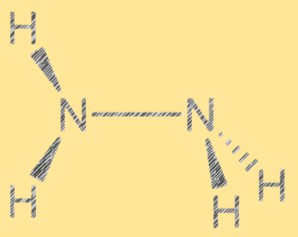
A estrutura de Lewis da hidrazina mostra o arranjo dos elétrons na molécula. A estrutura consiste em dois átomos de nitrogênio, cada um com um par de elétrons livres, e quatro átomos de hidrogênio. Os dois átomos de nitrogênio estão unidos por uma única ligação covalente e cada átomo de nitrogênio também está ligado a dois átomos de hidrogênio. A estrutura de Lewis da hidrazina ajuda a explicar sua reatividade e propriedades.
Nome do composto N2H4:
O nome do composto N2H4 é hidrazina. O nome vem do fato de que a hidrazina é um composto que contém átomos de hidrogênio e nitrogênio. A hidrazina também é conhecida por vários outros nomes, incluindo diamina, diazano e hidreto de nitrogênio.
Massa molar N2H4:
A massa molar da hidrazina, com fórmula molecular N2H4, é 32,04 g/mol. É um composto relativamente leve que consiste em dois átomos de nitrogênio e quatro átomos de hidrogênio. A baixa massa molar da hidrazina é uma das razões pelas quais ela é comumente usada como combustível de foguete, pois fornece uma alta relação empuxo-peso.
Ponto de ebulição da hidrazina:
A hidrazina tem um ponto de ebulição de 113,5 °C (236,3 °F) à pressão atmosférica. Este baixo ponto de ebulição significa que a hidrazina pode vaporizar facilmente, o que pode tornar seu manuseio perigoso. Quando aquecida, a hidrazina pode se decompor em gás nitrogênio e gás hidrogênio, o que também pode torná-la perigosa.
Ponto de fusão da hidrazina:
O ponto de fusão da hidrazina é -51,7 °C (-61,06 °F). Isso significa que a hidrazina é um líquido à temperatura e pressão ambientes. Seu baixo ponto de fusão também significa que pode solidificar facilmente em temperaturas mais frias, o que pode dificultar o manuseio.
Densidade de hidrazina g/ml:
A densidade da hidrazina é 1,00 g/mL à temperatura e pressão ambientes. Isso significa que a hidrazina é ligeiramente mais densa que a água, que tem densidade de 1,00 g/mL nas mesmas condições.
Peso molecular da hidrazina:
O peso molecular da hidrazina é 32,04 g/mol. Este valor é usado para calcular a quantidade de hidrazina necessária em reações químicas e outras aplicações.
Estrutura da hidrazina:
A estrutura da hidrazina consiste em dois átomos de nitrogênio ligados entre si por uma única ligação covalente, com cada átomo de nitrogênio também ligado a dois átomos de hidrogênio. Isso dá à hidrazina uma estrutura molecular simétrica em forma de V. A estrutura da hidrazina desempenha um papel importante na sua reatividade e propriedades.
Fórmula de hidrazina:
A fórmula química da hidrazina é N2H4. Esta fórmula indica que a hidrazina é composta por dois átomos de nitrogênio e quatro átomos de hidrogênio. A fórmula é usada para representar a hidrazina em equações e reações químicas.
| Aparência | Líquido incolor a amarelo pálido |
| Gravidade Específica | 1,00g/ml |
| Cor | Incolor |
| Cheiro | Cheiro de amônia |
| Massa molar | 32,04 g/mol |
| Densidade | 1,00g/ml |
| Ponto de fusão | -51,7°C (-61,06°F) |
| Ponto de ebulição | 113,5°C (236,3°F) |
| Ponto flash | 38°C (100°F) |
| Solubilidade em Água | Miscível |
| Solubilidade | Solúvel em etanol, éter dietílico, clorofórmio |
| Pressão de vapor | 72 mmHg a 20°C |
| Densidade do vapor | 1,0 (ar=1) |
| pKa | 8 |
| pH | Básico (pH > 7) |
Segurança e perigos da hidrazina
A hidrazina é um composto altamente reativo e perigoso que requer manuseio e armazenamento cuidadosos. É tóxico e pode causar queimaduras graves em contato com a pele, olhos ou mucosas. A inalação de vapores de hidrazina também pode causar irritação respiratória, danos aos pulmões e, em casos extremos, ser fatal. A hidrazina também é inflamável e pode inflamar-se facilmente, principalmente em contato com certos materiais, como agentes oxidantes. Devido a esses perigos, precauções de segurança adequadas e equipamentos de proteção individual devem ser utilizados no manuseio da hidrazina, e ela só deve ser utilizada em áreas bem ventiladas por profissionais qualificados que tenham recebido treinamento de segurança adequado.
| Símbolos de perigo | Caveira e ossos cruzados, chama |
| Descrição de segurança | Use apenas em áreas bem ventiladas. Use luvas, roupas e proteção para os olhos/face. Evite contato com a pele, olhos e roupas. Manter afastado do calor, faíscas e chamas. |
| Números de identificação da ONU | ONU 2030 |
| Código SH | 282510 |
| Classe de perigo | 6.1 (Substâncias tóxicas) |
| Grupo de embalagem | II |
| Toxicidade | Muito tóxico por ingestão, inalação e contato com a pele. Pode causar queimaduras graves e danos aos tecidos. A exposição a longo prazo pode causar danos ao fígado e aos rins e pode ser potencialmente cancerígena. |
Métodos de síntese de hidrazina
A hidrazina pode ser sintetizada por vários métodos, dependendo da pureza desejada e da aplicação específica. Alguns métodos comuns de síntese de hidrazina são:
- Processo Raschig: Este método envolve a reação de amônia e hipoclorito de sódio na presença de um catalisador como cobre ou níquel.
- Processo Olin-Raschig: Este processo envolve a reação da uréia e do ácido clorídrico para produzir hidrato de hidrazina.
- Processo cetazina: Este processo envolve a reação da acetona com amônia na presença de um catalisador como o níquel de Raney.
- Processo de peróxido: Este processo envolve a reação de peróxido de hidrogênio e amônia na presença de um catalisador como platina ou paládio.
- Processo Bayer: Este processo envolve a reação do hipoclorito de sódio com ureia na presença de um catalisador como cobre ou níquel.
- Reação de Houben-Hoesch: Esta reação envolve a reação do ácido nitroso com amônia na presença de um agente redutor como o zinco.
Cada método tem suas próprias vantagens e desvantagens, e a escolha do método dependerá de fatores como custo, rendimento, pureza e considerações de segurança. A síntese da hidrazina deve ser realizada com cautela, pois a hidrazina é uma substância perigosa e pode representar risco à saúde e segurança humana se não for manuseada corretamente.
Usos da hidrazina
O N2H4 possui uma ampla gama de aplicações industriais, comerciais e militares devido às suas propriedades químicas únicas. Alguns usos comuns do N2H4 incluem:
- As empresas usam N2H4 como combustível de foguete devido ao seu alto conteúdo energético e estabilidade.
- O N2H4 é usado como agente de polimerização na produção de certos polímeros, incluindo náilon e Kevlar.
- Os químicos usam o N2H4 como agente redutor em reações de síntese química, particularmente na produção de produtos farmacêuticos, pesticidas e outros compostos orgânicos.
- O N2H4 funciona como agente redutor em processos de metalização, principalmente para niquelagem.
- As estações de tratamento de água utilizam N2H4 como eliminador de oxigênio, especialmente em caldeiras e torres de resfriamento.
- Os fotógrafos usam o N2H4 como revelador fotográfico, principalmente em fotografia em preto e branco.
- Os fabricantes de automóveis contam com o N2H4 como inflador em sistemas de airbags de automóveis.
- As indústrias utilizam o N2H4 como agente de limpeza para determinados equipamentos e superfícies, principalmente na indústria eletrônica.
Embora a hidrazina tenha muitas aplicações úteis, também é uma substância perigosa e deve ser manuseada com cuidado. Precauções de segurança adequadas e equipamentos de proteção individual devem ser usados ao manusear a hidrazina e só devem ser usados por profissionais qualificados que tenham recebido treinamento de segurança apropriado.
Questões:
Qual é o número de oxidação (estado de oxidação) do N no N2H4?
No N2H4, o número de oxidação (estado de oxidação) do N é -2. Cada átomo de hidrogênio tem um número de oxidação +1 e, como o N2H4 é uma molécula neutra, a soma dos números de oxidação de todos os átomos deve ser igual a zero. Como existem dois átomos de nitrogênio no N2H4, o número total de oxidação do nitrogênio na molécula é -4. Portanto, o número de oxidação de cada átomo de nitrogênio é -2, o que equilibra os números de oxidação dos átomos de hidrogênio.
Qual é o nome do composto N2H4?
O composto N2H4 é comumente chamado de hidrazina.
Quais são as proporções molares de hidrazina (n2h4) para peróxido de hidrogênio (h2o2) e de hidrazina para água?
As proporções molares de hidrazina (N2H4) para peróxido de hidrogênio (H2O2) e de hidrazina para água podem ser determinadas a partir das equações químicas balanceadas das respectivas reações.
Quando a hidrazina reage com o peróxido de hidrogênio, ela produz gás nitrogênio (N2), água (H2O) e gás oxigênio (O2) de acordo com a seguinte equação balanceada:
N2H4 + H2O2 → N2 + 2H2O + O2
De acordo com esta equação, a proporção molar de hidrazina para peróxido de hidrogênio é de 1:1. Isto significa que para cada mol de hidrazina utilizado na reação, é consumido um mol de peróxido de hidrogênio.
Quando a hidrazina reage com a água, forma hidrato de hidrazina, que possui a fórmula química N2H4·H2O. A equação química balanceada para esta reação é:
N2H4 + H2O → N2H4·H2O
De acordo com esta equação, a razão molar hidrazina/água é 1:1. Isto significa que para cada mol de hidrazina utilizado na reação, um mol de água é consumido e um mol de hidrato de hidrazina é produzido.
