Os elementos são agrupados com base em características comuns, incluindo configurações eletrônicas e comportamento dos elétrons de valência.
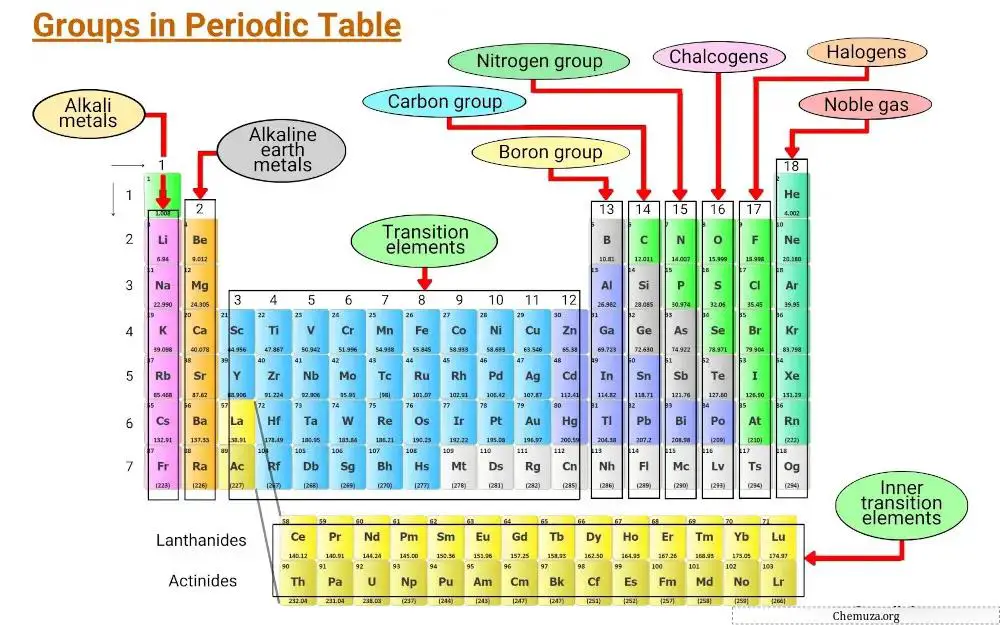
As colunas verticais da tabela periódica são chamadas de grupos, e existem 18 grupos na tabela periódica, cada um com seu próprio conjunto de propriedades que determinam como um elemento irá interagir com outros elementos e formar compostos.
Neste artigo, exploraremos os diferentes grupos da tabela periódica.
Vamos direto ao assunto!
Grupo 1: Metais alcalinos
O grupo 1 da tabela periódica é conhecido como metais alcalinos .
Este grupo inclui lítio, sódio, potássio, rubídio, césio e frâncio.
Os metais alcalinos são conhecidos pela sua suavidade, baixo ponto de fusão e alta reatividade com água e ar.
Os metais alcalinos são muito reativos porque possuem apenas um elétron em sua camada mais externa, que cede facilmente para formar íons positivos. [1]
Isto os torna excelentes condutores de eletricidade e úteis em muitas aplicações, incluindo baterias e processos industriais.
Entretanto, devido à sua alta reatividade, os metais alcalinos devem ser manuseados com cuidado. Eles podem inflamar-se espontaneamente no ar e reagir explosivamente com a água, liberando gás hidrogênio. [2]
Grupo 2: Metais alcalino-terrosos
O grupo 2 da tabela periódica é conhecido como “ metais alcalino-terrosos ”. Este grupo inclui seis elementos: berílio, magnésio, cálcio, estrôncio, bário e rádio.
Esses metais são chamados de “alcalinos” porque reagem com a água para formar soluções alcalinas (básicas) .
Os metais alcalino-terrosos têm propriedades semelhantes, incluindo altos pontos de fusão e ebulição, baixas densidades e a capacidade de formar facilmente íons com carga +2.
Eles também são muito reativos, especialmente com água e oxigênio. No entanto, ao contrário dos metais alcalinos do Grupo 1, são menos reativos e têm um ponto de fusão mais elevado.
Esses elementos são encontrados em muitos objetos do cotidiano, incluindo ossos (cálcio), fogos de artifício (estrôncio) e peças de aviões (magnésio).
Os metais alcalino-terrosos também são utilizados em processos industriais, como a produção de alumínio e aço.
Grupo 3 – 11: Metais de transição
O grupo 3 a 11 da tabela periódica é conhecido como grupo de metais de transição . Esses metais possuem características únicas que os diferenciam dos demais itens da mesa.
Uma das características definidoras dos metais de transição é a sua capacidade de formar compostos coloridos.
Isto se deve às suas configurações eletrônicas únicas, que lhes permitem absorver e refletir certos comprimentos de onda de luz. [3]
Os metais de transição também são conhecidos por seus altos pontos de fusão e ebulição, bem como por sua resistência e durabilidade.
Eles são frequentemente usados em materiais de construção, fiação elétrica e até mesmo em joias.
Grupo 13: grupo boro
O grupo 13 da tabela periódica é conhecido como grupo do boro e inclui os elementos boro (B), alumínio (Al), gálio (Ga), índio (In), tálio (Tl) e niônio (Nh).
Esses elementos compartilham certas características que os tornam quimicamente semelhantes.
O boro é o único metalóide deste grupo, o que significa que possui propriedades metálicas e não metálicas .
Grupo 14: Grupo Carbono
O grupo 14 da tabela periódica é conhecido como grupo Carbono e inclui Carbono (C), Silício (Si), Germânio (Ge), Estanho (Sn), Chumbo (Pb) e Fleróvio (Fl).
Esses elementos têm propriedades semelhantes porque todos possuem quatro elétrons de valência.
O carbono é um elemento muito importante porque forma a base de todas as moléculas orgânicas, incluindo os blocos de construção da vida, como as proteínas e o DNA. [4]
Grupo 15: Pnictógenos
O grupo 15 da tabela periódica também é conhecido como grupo nitrogênio (ou pnictógenos).
Este grupo contém 6 elementos: nitrogênio (N), fósforo (P), arsênico (As), antimônio (Sb), bismuto (Bi) e moscóvio (Mc).
Os elementos do grupo 15 têm cinco elétrons de valência em sua camada eletrônica mais externa, o que significa que tendem a formar três ligações covalentes para completar seu octeto.
Eles também tendem a ganhar três elétrons para formar ânions . Os elementos tornam-se menos não metálicos e mais metálicos no grupo.
Grupo 16: Calcogênios
O grupo 16 da tabela periódica é conhecido como grupo do oxigênio. Inclui os elementos oxigênio (O), enxofre (S), selênio (Se), telúrio (Te), polônio (Po) e hepático (Lv).
Esses elementos compartilham certas características, incluindo seis elétrons de valência em seu nível de energia mais externo.
O oxigênio é o elemento mais abundante deste grupo e é essencial para a vida, pois é um componente chave da água e de muitas moléculas orgânicas.
Os elementos do grupo do oxigênio podem formar compostos com muitos outros elementos, incluindo metais e não metais .
Grupo 17: Halogênios
O grupo 17 da tabela periódica também é conhecido como grupo halogênio . É composto por seis elementos: flúor, cloro, bromo, iodo, astato e tennessina.
Todos os halogênios possuem sete elétrons em sua camada mais externa, também conhecida como camada de valência. Isto os torna muito reativos, pois precisam apenas de um elétron extra para completar sua camada externa e se tornarem estáveis.
Outra característica importante dos halogênios é que eles são todos não-metais, o que significa que não conduzem eletricidade e não são maleáveis ou dúcteis como os metais.
Eles também existem em todos os três estados da matéria à temperatura ambiente, sendo o flúor e o cloro gases, o bromo sendo líquido e o iodo e o astato sendo sólidos.
Grupo 18: Gases raros
O grupo 18 da tabela periódica também é conhecido como gases nobres .
Os gases nobres incluem hélio (He), néon (Ne), argônio (Ar), criptônio (Kr), xenônio (Xe) e radônio (Rn).
Esses gases são chamados de nobres porque são muito estáveis e não reagem facilmente com outros elementos.
Os gases nobres estão localizados na coluna mais à direita da tabela periódica e todos possuem uma camada externa completa de elétrons, o que os torna muito pouco reativos.
Eles também são inodoros, incolores e têm baixos pontos de ebulição e fusão.
