O fosgênio é um gás tóxico usado em processos industriais e na guerra. A inalação representa sérios riscos à saúde, causando danos respiratórios e pode ser fatal.
| Nome IUPAC | Dicloreto de carbonila |
| Fórmula molecular | COCl2 |
| Número CAS | 75-44-5 |
| Sinônimos | Dicloreto de carbono, gás fosgênio, cloreto de carbonila |
| InChI | InChI=1S/CCl2O/c2-1(3)4 |
Propriedades do fosgênio
Fórmula Fosgênio
A fórmula química do fosgênio ou dicloreto de carbono é COCl2. Consiste em um átomo de carbono (C), um átomo de oxigênio (O) e dois átomos de cloro (Cl). Esta composição molecular é essencial para a compreensão de suas propriedades e reações.
Massa molar de Fosgênio
A massa molar do dicloreto de carbono é aproximadamente 98,92 g/mol. É calculado somando as massas atômicas de seus constituintes, que são carbono (12,01 g/mol), oxigênio (16,00 g/mol) e cloro (35,45 g/mol cada).
Ponto de ebulição do fosgênio
O dicloreto de carbono tem um ponto de ebulição relativamente baixo, em torno de -23,3°C (-9,94°F). Nessa temperatura, ele passa do estado líquido para o estado gasoso, o que é fundamental para sua aplicação em diversos processos industriais.
Ponto de fusão do Fosgênio
O ponto de fusão do dióxido de carbono é bastante baixo, em torno de -118,3°C (-180,94°F). A esta temperatura, a forma sólida do dicloreto de carbono se transforma em líquido. Compreender esta propriedade é importante para manusear o dicloreto de carbono com segurança.
Densidade de fosgênio g/mL
O dicloreto de carbono tem uma densidade de aproximadamente 1,432 g/mL à temperatura ambiente (25°C ou 77°F). Esta propriedade é crucial na determinação do seu comportamento e interações com outras substâncias.
Peso Molecular do Fosgênio
O peso molecular do dicloreto de carbono é 98,92 g/mol. Este valor é vital para vários cálculos em química, incluindo estequiometria e determinação da quantidade de dicloreto de carbono necessária para as reações.
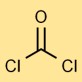
Estrutura do fosgênio
O dicloreto de carbono tem uma estrutura molecular linear, na qual o átomo de carbono está duplamente ligado ao átomo de oxigênio e simples a cada átomo de cloro. Este arranjo afeta sua capacidade de resposta e estabilidade.
Solubilidade do fosgênio
O dicloreto carbônico é pouco solúvel em água, com apenas uma pequena quantidade de gás se dissolvendo no líquido. No entanto, pode reagir com a água para produzir ácido clorídrico e dióxido de carbono, tornando-o perigoso em ambientes aquosos.
Compreender essas propriedades do dicloreto de carbono é essencial para o manuseio e uso seguro do produto químico em aplicações industriais e outros ambientes. Devem sempre ser tomadas precauções adequadas ao manusear este composto tóxico e reativo para evitar acidentes e riscos à saúde.
| Aparência | Gás incolor |
| Gravidade Específica | 3.428 (gás) |
| Cor | N / D |
| Cheiro | Sufocante, ardendo |
| Massa molar | 98,92 g/mol |
| Densidade | 1.432 g/mL (líquido) |
| Ponto de fusão | -118,3°C (-180,94°F) |
| Ponto de ebulição | -23,3°C (-9,94°F) |
| Ponto flash | N / D |
| Solubilidade em Água | Reage com água |
| Solubilidade | Reage com água para produzir ácido clorídrico e dióxido de carbono |
| Pressão de vapor | 736 mmHg (25°C) |
| Densidade do vapor | 2,98 (ar = 1) |
| pKa | N / D |
| pH | N / D |
Essas propriedades físico-químicas fornecem informações essenciais sobre o dicloreto de carbono, facilitando seu manuseio seguro e a compreensão de seu comportamento em diversos ambientes.
Segurança e perigos do fosgênio
O dicloreto de carbono apresenta riscos de segurança significativos devido à sua natureza tóxica e reativa. Ao manusear dicloreto de carbono, use equipamento de proteção individual (EPI) adequado, incluindo proteção respiratória, luvas e proteção para os olhos. Garantir ventilação adequada nas áreas de trabalho para evitar exposição por inalação. Evite o contato com a pele e os olhos, pois pode causar irritação e queimaduras graves. O gás dicloreto de carbono não tem odor, dificultando sua detecção. Os dispositivos de monitorização são, portanto, cruciais. Se exposto, procure atendimento médico imediatamente. Armazene e transporte o dicloreto de carbono com segurança, de acordo com os regulamentos e melhores práticas. Compreender os seus perigos é essencial para prevenir acidentes e proteger a saúde humana e o ambiente.
| Símbolos de perigo | Caveira e ossos cruzados |
| Descrição de segurança | Gás altamente tóxico. Manuseie com extremo cuidado. Use EPI apropriado. Evite inalação e contato com a pele. |
| Números de identificação da ONU | UN1076 |
| Código SH | 2812.10.0000 |
| Classe de perigo | 2.3 (Gás tóxico) |
| Grupo de embalagem | EU |
| Toxicidade | O fosgênio é altamente tóxico e pode ser fatal por inalação ou contato com a pele. Use medidas de segurança rigorosas. |
Compreender os aspectos de risco e segurança do dicloreto de carbono é crucial para um manuseio seguro e prevenção de acidentes. É altamente tóxico e apresenta riscos significativos à saúde, tornando essenciais procedimentos e precauções de segurança adequados.
Métodos de síntese de fosgênio
Vários métodos permitem a síntese de dicloreto de carbono.
Uma abordagem comum é o “processo Deacon”, no qual o cloro gasoso reage com o monóxido de carbono a temperaturas elevadas na presença de um catalisador adequado, como o cloreto de cobre (II) . Outro método envolve a “cloração direta” do monóxido de carbono com cloro gasoso, facilitada por ferro ou outros cloretos metálicos como catalisadores.
A produção de dicloreto de carbono envolve a “carbonilação oxidativa” de cloreto de metileno ou cloreto de metila, usando oxigênio e um catalisador metálico como o cloreto cuproso. Outro método de síntese de dicloreto de carbono é a “rota da ureia”, que gera dicloreto de carbono como subproduto durante a produção de uréia.
No entanto, é essencial notar que o dicloreto de carbono é uma substância muito perigosa e a sua síntese requer o máximo cuidado e perícia. Os trabalhadores devem realizar estes processos em ambientes industriais bem controlados, com rigorosas medidas de segurança e equipamentos de proteção para evitar a exposição a gases tóxicos e garantir a sua segurança e a do meio ambiente.
Usos do fosgênio
O dicloreto de carbono possui diversas aplicações industriais devido às suas propriedades únicas, mas é importante ressaltar que seus usos devem ser tratados com extrema cautela devido à sua natureza tóxica. Aqui estão alguns de seus usos:
- Intermediários Químicos: O dicloreto carbônico ajuda a produzir vários produtos químicos essenciais, incluindo isocianatos, que desempenham um papel essencial na fabricação de espumas, revestimentos e adesivos de poliuretano.
- Produção de pesticidas: O dicloreto de carbono facilita a síntese de certos pesticidas e herbicidas, contribuindo assim para a protecção das culturas e o controlo de pragas.
- Produção de policarbonato: O dióxido de carbono é um componente crucial na produção de plásticos de policarbonato, utilizado numa vasta gama de produtos, desde óculos a garrafas de água.
- Indústria têxtil: O dicloreto de carbono está envolvido na produção de corantes específicos e outros produtos químicos utilizados na indústria têxtil.
- Produção de espuma: O dióxido de carbono desempenha um papel fundamental na fabricação de materiais de espuma, incluindo alguns tipos de espuma utilizados em isolamento.
- Produtos farmacêuticos: O dicloreto carbônico atua como intermediário químico na produção de certos produtos farmacêuticos.
- Pesquisa de laboratório: Os pesquisadores às vezes usam dicloreto de carbono em experimentos de laboratório.
- Produção de borracha sintética: O dióxido de carbono é parte integrante da produção de algumas borrachas sintéticas.
- Purificação de água: O dicloreto de carbono já havia sido usado em pequenas quantidades para purificação de água, mas hoje em dia alternativas mais seguras são mais comumente utilizadas para esse fim.
Embora o dicloreto de carbono tenha usos industriais importantes, sua alta toxicidade e propriedades perigosas exigem medidas rigorosas de segurança durante o manuseio, armazenamento e transporte para prevenir acidentes e garantir o bem-estar dos trabalhadores e das pessoas. o ambiente.
Questões:
P: O que o gás fosgênio faz a uma pessoa?
R: O gás dicloreto de carbono pode causar lesões respiratórias, causando dificuldade para respirar e edema pulmonar potencialmente fatal.
P: O que é fosgênio?
R: O dióxido de carbono é um composto químico altamente tóxico utilizado em vários processos industriais.
P: O que é gás fosgênio?
R: O gás dicloreto de carbono é a forma gasosa do composto químico, conhecido por seus efeitos sufocantes e tóxicos no sistema respiratório.
P: O que o fosgênio faz ao corpo?
R: O dióxido de carbono pode danificar os pulmões, causando acúmulo de líquidos e dificuldade respiratória grave.
P: Com que frequência Grignard reagirá com o fosgênio?
R: O reagente de Grignard reage com o dicloreto de carbono apenas uma vez, formando uma cetona.
P: Qual órgão humano é atacado pelo gás cloro e pelo fosgênio?
R: Os gases cloro e dicloreto de carbono atacam principalmente os pulmões.
P: Como o gás fosgênio mata você?
R: O gás dicloreto de carbono causa irritação pulmonar grave, levando ao acúmulo de líquidos e asfixia.
P: Quem inventou o gás fosgênio?
R: O gás dióxido de carbono foi descoberto pelo químico britânico John Davy em 1812.
P: Efeitos do gás dicloreto de carbono?
R: O gás dicloreto de carbono pode causar danos respiratórios, edema pulmonar e, em casos graves, morte.
P: Estrutura de Lewis do dióxido de carbono?
R: A estrutura de Lewis do dicloreto de carbono consiste em um carbono duplamente ligado ao oxigênio e uma ligação simples a dois átomos de cloro.
P: Gás dicloreto de carbono na Primeira Guerra Mundial?
R: O dicloreto de carbono foi usado como arma química durante a Primeira Guerra Mundial, causando efeitos devastadores nos soldados.
P: Quando o gás fosgênio foi usado pela primeira vez?
R: O gás dicloreto de carbono foi usado pela primeira vez como arma química durante a Primeira Guerra Mundial em 1915.
P: De onde vem o fosgênio?
R: O dióxido de carbono é geralmente produzido pela reação do cloro com monóxido de carbono ou outros compostos que contenham carbono.
