Fosfato de sódio dibásico ou Na2HPO4 é um composto comumente usado como agente tampão em laboratório. Também pode ser encontrado em alguns produtos alimentícios e bebidas como aditivo alimentar.
| Nome IUPAC | Hidrogenofosfato dissódico |
| Fórmula molecular | Na2HPO4 |
| Número CAS | 7558-79-4 |
| Sinônimos | Hidrogenofosfato de sódio, Fosfato dissódico, Fosfato de sódio dibásico, Fosfato de sódio dibásico anidro, Fosfato de sódio dibásico heptahidratado |
| InChI | InChI=1S/2Na.H3O4P/c;;1-5(2,3)4/h;;(H3,1,2,3,4)/q2*+1;/p-2 |
Massa molar Na2HPO4
A massa molar do fosfato de sódio dibásico é 141,96 g/mol. Esse valor é calculado somando as massas atômicas de cada um dos elementos presentes no composto, que são o sódio (Na), o fósforo (P) e o oxigênio (O). A massa molar é um parâmetro importante utilizado em vários cálculos, por exemplo, para determinar a quantidade de uma substância necessária para realizar uma reação ou para preparar uma solução com uma determinada concentração.
Fórmula de Fosfato Dissódico
A fórmula química do fosfato de sódio dibásico é Na2HPO4. Esta fórmula representa a proporção de cada um dos elementos presentes no composto. A fórmula é importante na determinação das propriedades químicas do composto, como sua reatividade e solubilidade.
Ponto de ebulição dibásico do fosfato de sódio
O fosfato de sódio dibásico não tem ponto de ebulição definido porque se decompõe antes de atingir o ponto de ebulição. No entanto, a temperatura de decomposição do fosfato de sódio dibásico seria em torno de 155°C. Em temperaturas acima deste valor, o composto começa a se decompor em seus íons constituintes, sódio e fosfato. Esta propriedade o torna inadequado para uso em aplicações que requerem aquecimento a altas temperaturas.
Ponto de fusão do fosfato de sódio dibásico
O ponto de fusão do Na2HPO4 varia dependendo da forma em que está presente. A forma anidra do composto tem um ponto de fusão de 358°C, enquanto a forma heptahidratada tem um ponto de fusão inferior de 93°C. O ponto de fusão é uma importante propriedade física usada para identificar e caracterizar substâncias.
Densidade dibásica de fosfato de sódio g/ml
A densidade do Na2HPO4 depende da forma em que está presente. A forma anidra do composto tem densidade de 1,7 g/mL, enquanto a forma heptahidratada tem densidade menor de 1,68 g/mL. A densidade é uma propriedade física que descreve a quantidade de massa contida em um determinado volume de uma substância.
Peso Molecular Dibásico de Fosfato de Sódio
O peso molecular do Na2HPO4 é 141,96 g/mol. Este valor é calculado somando as massas atômicas de cada um dos elementos presentes no composto. O peso molecular é um parâmetro importante utilizado em vários cálculos, por exemplo, para determinar a quantidade de uma substância necessária para realizar uma reação ou para preparar uma solução com uma determinada concentração.
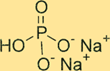
Estrutura dibásica do fosfato de sódio
O Na2HPO4 possui uma estrutura cristalina. A forma anidra do composto é um pó branco e inodoro, enquanto a forma heptahidratada é um cristal transparente e incolor. O composto tem uma forma tetraédrica em torno do átomo de fósforo, com cada átomo de oxigênio localizado nos cantos do tetraedro. Os íons de sódio estão localizados nos espaços intersticiais entre os tetraedros.
| Aparência | Pó branco ou cristais transparentes |
| Gravidade Específica | 1,68 – 1,7g/mL |
| Cor | Incolor a branco |
| Cheiro | Inodoro |
| Massa molar | 141,96 g/mol |
| Densidade | 1,68 – 1,7g/mL |
| Ponto de fusão | Anidro: 358°C, Heptahidrato: 93°C |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel |
| Solubilidade | Solúvel em água, insolúvel em etanol |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| PKa | 2,15 (íon fosfato) |
| PH | 8,0 – 11,0 (solução aquosa 0,1 M) |
Segurança e perigos do fosfato de sódio dibásico
O fosfato de sódio dibásico (Na2HPO4) é geralmente considerado seguro para uso em diversas aplicações, mas pode causar irritação na pele e nos olhos. A inalação do composto em pó pode causar irritação respiratória. O Na2HPO4 pode reagir violentamente com ácidos fortes e agentes oxidantes e pode liberar vapores tóxicos quando aquecido a altas temperaturas. Tal como acontece com todos os produtos químicos, devem ser tomadas precauções adequadas ao manusear este composto, como usar roupas e luvas de proteção e trabalhar em uma área bem ventilada. Em caso de contato com a pele ou olhos, enxaguar com água abundante e consultar um médico se necessário.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | S22 – Não respirar as poeiras, S24 – Evitar o contacto com a pele, S37 – Usar luvas adequadas |
| Identificadores AN | UN3077 |
| Código SH | 28352200 |
| Classe de perigo | 9 |
| Grupo de embalagem | III |
| Toxicidade | LD50 (rato, oral) – 3.400 mg/kg |
Métodos para a síntese de fosfato de sódio dibásico
O fosfato de sódio dibásico (Na2HPO4) pode ser sintetizado por vários métodos, incluindo a reação do ácido fosfórico com hidróxido de sódio, a neutralização do ácido fosfórico com carbonato ou bicarbonato de sódio e a reação do fosfato de sódio monobásico com hidróxido de sódio.
- Um método comum é reagir o ácido fosfórico com hidróxido de sódio na proporção de 1:2 para produzir Na2HPO4 e água. A reação pode ser realizada à temperatura ambiente ou sob aquecimento suave, e o produto resultante é purificado por cristalização ou evaporação.
- Outro método é neutralizar o ácido fosfórico com carbonato ou bicarbonato de sódio, seguido de precipitação de Na2HPO4. O pH da mistura reaccional é ajustado para aproximadamente 8-9 utilizando carbonato ou bicarbonato de sódio, e o precipitado resultante é recolhido e lavado com água para remover quaisquer impurezas.
- Um terceiro método envolve a reação de fosfato de sódio monobásico com hidróxido de sódio na proporção de 1:1, resultando na formação de Na2HPO4 e água. O produto resultante é então purificado por cristalização ou evaporação.
A escolha do método depende de fatores como pureza desejada, rendimento e custo-benefício. A síntese de Na2HPO4 pode ser realizada por diversos métodos, cada um com suas vantagens e limitações.
Usos do fosfato de sódio dibásico
O fosfato de sódio dibásico tem muitas aplicações em diferentes indústrias.
- A indústria alimentícia o utiliza como emulsificante, tampão e agente espessante. Atua como sequestrante, ajudando a preservar a qualidade e a estabilidade dos alimentos, evitando que os íons metálicos reajam com outros componentes dos alimentos. Serve como agente de saída em fermento em pó e como ajustador de pH em laticínios.
- A indústria médica o utiliza como laxante para tratar a constipação, aumentando o teor de água do cólon. Também é utilizado na preparação de medicamentos e injeções como ajustador e tampão de pH.
- Na indústria agrícola, atua como fertilizante, fornecendo fósforo às plantas.
- Também funciona como suplemento nutricional na alimentação animal.
- A indústria de tratamento de água utiliza Na2HPO4 como inibidor de corrosão e inibidor de incrustações em caldeiras e sistemas de refrigeração.
- Atua como agente de limpeza, removendo depósitos de cálcio e magnésio das superfícies.
Questões:
P: O fosfato de sódio dibásico é um conservante?
R: O Na2HPO4 geralmente não é usado como conservante em produtos alimentícios. No entanto, pode atuar como sequestrante, o que pode ajudar a preservar a qualidade e a estabilidade dos alimentos, evitando que os íons metálicos reajam com outros componentes dos alimentos.
P: Quantos moles de fosfato de sódio dibásico (PM 141,98) existem em 50 ml de uma solução a 20% p/v?
R: Para calcular o número de moles em uma solução de Na2HPO4 a 20% p/v, primeiro precisamos converter a porcentagem peso/volume para gramas/100 ml. Uma solução a 20% p/v significa 20 gramas de composto em 100 ml de solução. Portanto, 50 ml de solução contêm 10 gramas de Na2HPO4. Para calcular o número de moles, divida a massa pelo peso molecular:
moles = massa / peso molecular moles = 10 g / 141,98 g/mol moles = 0,070 moles
Portanto, existem 0,070 moles de Na2HPO4 em 50 ml de uma solução a 20% p/v.
P: Qual é a densidade do fosfato de sódio dibásico?
R: A densidade do Na2HPO4 depende da forma e concentração do composto. A forma anidra possui densidade de aproximadamente 2,36 g/cm³, enquanto a forma heptahidratada possui densidade de aproximadamente 1,62 g/cm³. Em solução, a densidade irá variar dependendo da concentração.
