O fosfato de magnésio (Mg3(PO4)2) é um composto composto por íons magnésio e fosfato. Desempenha um papel vital em muitos processos biológicos, como síntese de DNA, função nervosa e contração muscular.
| Nome IUPAC | Fosfato de Magnésio |
| Fórmula molecular | Mg3(PO4)2 |
| Número CAS | 7757-87-1 |
| Sinônimos | Fosfato de trimagnésio, ortofosfato de trimagnésio, ortofosfato de magnésio, fosfato de magnésio terciário, fosfato de magnésio tribásico |
| InChI | InChI=1S/2Mg.3H3O4P/c;;3 1-5(2,3)4/h;;3 (H3,1,2,3,4)/q2*+2;;;/p-6 |
Propriedades do fosfato de magnésio
Fórmula de Fosfato de Magnésio
A fórmula química do fosfato de magnésio é Mg3(PO4)2, o que indica que ele contém três íons Mg+2 e dois íons PO43-. A fórmula é essencial em cálculos estequiométricos e auxilia na determinação da quantidade correta de reagentes e produtos em reações químicas envolvendo Mg3(PO4)2.
Massa molar de fosfato de magnésio
Mg3(PO4)2 tem massa molar de 262,86 g/mol. Este valor representa a massa de um mol do composto Mg3(PO4)2, que é uma combinação de três íons Mg+2 e dois íons PO4-. A massa molar é uma propriedade crucial usada em cálculos estequiométricos para determinar a quantidade de Mg3(PO4)2 necessária em diversas reações químicas.
Ponto de ebulição do fosfato de magnésio
O Mg3(PO4)2 não possui ponto de ebulição definido, pois se decompõe antes de atingir seu ponto de ebulição. Em altas temperaturas, o Mg3(PO4)2 se decompõe em óxido de magnésio e pentóxido de fósforo, que têm pontos de ebulição de 3.600°C e 300°C, respectivamente. A temperatura de decomposição do Mg3(PO4)2 depende de vários fatores como concentração, taxa de aquecimento e pressão.
Ponto de fusão do fosfato de magnésio
Mg3(PO4)2 tem um ponto de fusão de 1188°C. A esta temperatura, o composto sofre uma mudança de fase do estado sólido para o estado líquido. O ponto de fusão do Mg3(PO4)2 é influenciado por vários fatores, incluindo pressão, impurezas e estrutura cristalina.
Densidade de fosfato de magnésio g/mL
A densidade do Mg3(PO4)2 varia dependendo da estrutura cristalina e das condições sob as quais é medida. A forma mais comum de Mg3(PO4)2, tri-Mg3(PO4)2, tem densidade de 2,195 g/mL. O valor da densidade é essencial para determinar a massa de Mg3(PO4)2 necessária para atingir um volume específico em diversas aplicações.
Peso molecular do fosfato de magnésio
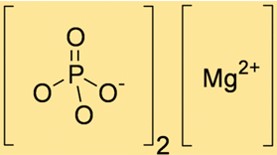
Mg3(PO4)2 tem peso molecular de 262,86 g/mol. Este valor é calculado somando os pesos atômicos dos íons Mg e PO43- presentes no composto. O peso molecular de Mg3(PO4)2 é útil na determinação da quantidade de Mg3(PO4)2 necessária em várias reações químicas.
Estrutura do fosfato de magnésio
O Mg3(PO4)2 possui uma estrutura cristalina que varia dependendo do método e das condições de preparação. A forma mais comum é o tri-Mg3(PO4)2, que possui uma estrutura cristalina composta por íons Mg+2 e íons PO43- dispostos em uma rede hexagonal. A estrutura cristalina influencia as propriedades físicas e químicas do Mg3(PO4)2.
| Aparência | Pó cristalino branco |
| Gravidade Específica | 2.195 |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 262,86 g/mol |
| Densidade | 2.195g/ml |
| Ponto de fusão | 1188°C |
| Ponto de ebulição | Decompõe-se antes do ponto de ebulição |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Insolúvel |
| Solubilidade | Solúvel em ácidos |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | 7.2 |
| pH | 8-9 (solução a 10%) |
Segurança e perigos do fosfato de magnésio
Mg3(PO4)2 é geralmente considerado seguro e não tóxico. Não é classificado como material perigoso e não apresenta riscos significativos à saúde humana ou ao meio ambiente. Contudo, a exposição prolongada a altas concentrações de poeira de Mg3(PO4)2 pode causar irritação respiratória. A ingestão de grandes quantidades de Mg3(PO4)2 pode causar irritação gastrointestinal e náusea. É importante manusear o Mg3(PO4)2 com cuidado e usar equipamento de proteção individual adequado ao manusear grandes quantidades do composto. Quaisquer derramamentos ou vazamentos devem ser limpos imediatamente para evitar qualquer risco de escorregamento ou queda.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Não classificado como perigoso |
| Números de identificação da ONU | Não aplicável |
| Código SH | 2835.29.10 |
| Classe de perigo | Não classificado |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Não tóxico em concentrações normais |
Métodos de síntese de fosfato de magnésio
Vários métodos podem sintetizar Mg3(PO4)2, incluindo precipitação, reação de óxido de magnésio com ácido fosfórico e reação de hidróxido de magnésio com ácido fosfórico.
O processo de precipitação envolve a adição de um sal fosfato solúvel, como Na3PO4, a uma solução contendo um sal solúvel de Mg+2, como MgCl2 ou sulfato de magnésio. Então, a mistura das duas soluções produz um precipitado de Mg3(PO4)2 que pode ser coletado e seco.
A reação envolve a adição de óxido de magnésio a uma solução de ácido fosfórico e o aquecimento da mistura para completar a reação. O processo então coleta e lava o Mg3(PO4)2 resultante para remover quaisquer impurezas.
A reação envolve a adição de hidróxido de magnésio a uma solução de ácido fosfórico e o aquecimento da mistura para completá-la. Em seguida, colete o Mg3(PO4)2 resultante e lave-o bem para remover todas as impurezas.
Dependendo da qualidade das matérias-primas e das condições de reação, esses métodos podem ser utilizados para produzir Mg3(PO4)2 com diversos graus de pureza.
Usos do fosfato de magnésio
Mg3(PO4)2 tem diversos usos em diversas indústrias, incluindo:
- Indústria Alimentar: Utilizado como aditivo alimentar para regular os níveis de acidez e melhorar a textura e qualidade de produtos de panificação, laticínios e bebidas.
- Agricultura: Usado como fertilizante para fornecer às plantas nutrientes essenciais, como magnésio e fósforo.
- Indústria Farmacêutica: Utilizado como ingrediente ativo em antiácidos e laxantes para ajudar a aliviar sintomas de indigestão e prisão de ventre.
- Tratamento de Água: Usado como produto químico de tratamento de água para controlar a formação de incrustações em caldeiras e tubulações e para prevenir corrosão.
- Indústria cerâmica: Usado como aglutinante cerâmico para melhorar a resistência e durabilidade dos produtos cerâmicos.
- Retardante de fogo: Usado como retardador de chama em materiais de construção, como isolamento, drywall e revestimento.
- Cosméticos: Utilizado em cosméticos e produtos de higiene pessoal como espessante e emulsificante.
Questões:
P: Qual é a fórmula correta para o composto formado entre os íons Mg+2 e PO43-?
R: A fórmula correta para o composto formado entre íons Mg+2 e íons PO43- é Mg3(PO4)2.
P: Qual é a fórmula do fosfato de magnésio?
R: A fórmula do fosfato de magnésio é Mg3(PO4)2.
P: Quantos íons constituem uma unidade de fórmula de fosfato de magnésio?
R: Uma unidade de fórmula de Mg3(PO4)2 contém 11 íons: três íons Mg+2 e dois íons PO43-.
P: O fosfato de magnésio é solúvel?
R: O Mg3(PO4)2 possui baixa solubilidade em água, com solubilidade de aproximadamente 0,1 g/100 mL à temperatura ambiente.
Q: Um ácido (x) reage com uma base (y) para produzir Mg3(PO4)2. O que são x e y?
R: O ácido (x) é o ácido fosfórico (H3PO4) e a base (y) é o hidróxido de magnésio (Mg(OH)2).
P: Qual é a massa molar do Mg3(PO4)2, uma substância anteriormente usada medicinalmente como antiácido?
R: A massa molar de Mg3(PO4)2 é 262,86 g/mol.
P: O Mg3 (PO4) 2 é solúvel em água?
R: O Mg3(PO4)2 possui baixa solubilidade em água, com solubilidade de aproximadamente 0,1 g/100 mL à temperatura ambiente.
P: Quantos mols de átomos de oxigênio existem em um mol de Mg3(PO4)2?
R: Um mol de Mg3(PO4)2 contém 8 moles de átomos de oxigênio.
