O fosfato de cálcio (Ca3(PO4)2) é um mineral encontrado nos dentes e ossos. Isso ajuda a torná-los fortes e saudáveis. Também é usado como suplemento dietético para prevenir a deficiência de cálcio.
| Nome IUPAC | Fosfato de cálcio |
| Fórmula molecular | Ca3(PO4)2 |
| Número CAS | 7758-87-4 |
| Sinônimos | Fosfato tricálcico, fosfato ósseo, ortofosfato de cálcio, fosfato de cálcio tribásico, TCP |
| InChI | InChI=1S/3Ca.2H3O4P/c;;;2 1-5(2,3)4/h;;;2 (H3,1,2,3,4)/q3*+2;;/p-6 |
Propriedades do fosfato de cálcio
Fórmula de Fosfato de Cálcio
A fórmula química do fosfato de cálcio é Ca3(PO4)2, o que indica que contém três íons cálcio e dois íons fosfato. A fórmula é usada para calcular a quantidade de fosfato de cálcio necessária para reações químicas. O fosfato de cálcio é um componente importante dos dentes e ossos e também é utilizado em diversas aplicações industriais, como aditivos alimentares e fertilizantes.
Massa molar de fosfato de cálcio
A massa molar do Ca3(PO4)2 é 310,18 g/mol. É calculado adicionando a massa atômica de cálcio, fósforo e oxigênio, que são 40,08 g/mol, 30,97 g/mol e 15,99 g/mol respectivamente. A massa molar é um parâmetro importante na determinação da quantidade de Ca3(PO4)2 necessária em uma reação química.
Ponto de ebulição do fosfato de cálcio
Ca3(PO4)2 não tem ponto de ebulição definido porque se decompõe antes de atingir seu ponto de ebulição. Quando aquecido, o Ca3(PO4)2 se decompõe em óxido de cálcio e pentóxido de fósforo, liberando vapor d’água. A temperatura de decomposição depende do tipo de Ca3(PO4)2 e da taxa de aquecimento.
Ponto de fusão do fosfato de cálcio
O ponto de fusão do Ca3(PO4)2 depende do tipo de Ca3(PO4)2. O ponto de fusão do fosfato tricálcico, a forma mais abundante de Ca3(PO4)2 na natureza, é de aproximadamente 1670°C. O fosfato dicálcico tem um ponto de fusão em torno de 1400°C, enquanto o fosfato monocálcico derrete em torno de 109°C.
Densidade de fosfato de cálcio g/mL
A densidade do Ca3(PO4)2 varia dependendo do tipo de Ca3(PO4)2. O fosfato tricálcico tem densidade de aproximadamente 3,14 g/mL, enquanto o fosfato dicálcico tem densidade de aproximadamente 2,31 g/mL. O fosfato monocálcico tem densidade de aproximadamente 2,22 g/mL.
Peso molecular do fosfato de cálcio
O peso molecular do Ca3(PO4)2 é 310,18 g/mol, o que corresponde à soma dos pesos atômicos do cálcio, fósforo e oxigênio. O peso molecular é importante para calcular a quantidade de Ca3(PO4)2 necessária para reações químicas.
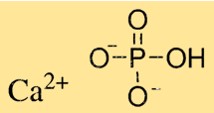
Estrutura do fosfato de cálcio
Ca3(PO4)2 possui uma estrutura cristalina complexa que depende do tipo de Ca3(PO4)2. O fosfato tricálcico possui estrutura cristalina hexagonal, enquanto o fosfato dicálcico possui estrutura cristalina monoclínica. O fosfato monocálcico possui uma estrutura cristalina tetragonal. Os cristais de Ca3(PO4)2 são compostos de íons cálcio e íons fosfato dispostos em um padrão específico.
| Aparência | Pó branco ou cristais |
| Gravidade Específica | 3.14 |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 310,18 g/mol |
| Densidade | 3,14 g/mL (fosfato tricálcico) |
| Ponto de fusão | 1670 °C (fosfato tricálcico) |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | N / D |
| Solubilidade em Água | 0,002 g/100 ml (a 25°C) |
| Solubilidade | Solúvel em ácidos, insolúvel em água |
| Pressão de vapor | N / D |
| Densidade do vapor | N / D |
| pKa | pKa1: 1,9, pKa2: 6,7, pKa3: 12,0 |
| pH | 5,5-7,5 (10% de suspensão em água) |
Segurança e perigos do fosfato de cálcio
O Ca3(PO4)2 é geralmente considerado seguro para consumo humano e não apresenta riscos significativos à saúde. É um mineral natural encontrado nos ossos e dentes e usado como suplemento dietético de várias formas. O Ca3(PO4)2 também é utilizado na indústria alimentícia como aditivo alimentar e condicionador de massa. No entanto, o consumo excessivo de suplementos de Ca3(PO4)2 pode levar a efeitos adversos, como dores de estômago, prisão de ventre e até danos renais. Além disso, a exposição a altos níveis de poeira de Ca3(PO4)2 no local de trabalho pode causar problemas respiratórios. Portanto, é importante usar suplementos e produtos de Ca3(PO4)2 com moderação e seguir as diretrizes de segurança industrial.
| Símbolos de perigo | Nenhum conhecido |
| Descrição de segurança | 26-36/37/39: Use roupas de proteção, luvas e proteção para os olhos/face adequadas. |
| Números de identificação da ONU | N / D |
| Código SH | 28352500 |
| Classe de perigo | Não classificado |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Baixa toxicidade |
Métodos de síntese de fosfato de cálcio
Existem vários métodos para a síntese de Ca3(PO4)2, incluindo precipitação, síntese hidrotérmica, processo sol-gel e reação no estado sólido.
O método de precipitação envolve a combinação de íons cálcio e fosfato em uma solução aquosa, resultando na formação de um precipitado por meio de reação química. O experimentador então lava e seca o precipitado para obter o composto Ca3(PO4)2 desejado.
A síntese hidrotérmica envolve a reação de fontes de cálcio e fosfato em um ambiente de alta pressão e alta temperatura. Para obter o composto Ca3(PO4)2 desejado, o produto resultante é lavado e seco.
No processo sol-gel, um sol, ou suspensão coloidal, é convertido em um gel e depois seco para obter o composto Ca3(PO4)2 desejado. Este método permite um controle preciso da composição e morfologia do composto obtido.
A reação no estado sólido envolve a mistura de pirofosfato de cálcio e carbonato de cálcio no estado sólido e depois o aquecimento da mistura para promover uma reação química. Para obter o composto Ca3(PO4)2 desejado, o produto obtido deve ser lavado e seco.
Usos do fosfato de cálcio
Ca3(PO4)2 tem muitos usos em diferentes indústrias devido às suas propriedades únicas. Alguns dos usos comuns do Ca3(PO4)2 são:
- Suplementos Dietéticos: Comumente usados em suplementos dietéticos como fonte de cálcio e fósforo, minerais essenciais para a saúde óssea.
- Indústria de Alimentos e Bebidas: Usado como aditivo alimentar em muitos alimentos processados, incluindo produtos de panificação, laticínios e bebidas. Na panificação, as pessoas o usam como agente de saída e fonte de cálcio.
- Indústria Farmacêutica: Utilizado na indústria farmacêutica como enchimento e aglutinante em comprimidos e cápsulas. Alguns medicamentos podem ter sua biodisponibilidade melhorada ao serem utilizados como agente de revestimento.
- Agricultura: Usado como fertilizante para fornecer às plantas nutrientes essenciais como cálcio e fósforo.
- Odontologia: Usado em odontologia para remineralizar os dentes e restaurar o esmalte dentário.
- Engenharia Biomédica: Também utilizada na engenharia biomédica para desenvolver substitutos de enxertos ósseos e melhorar as propriedades de biomateriais utilizados na engenharia de tecidos ósseos.
Questões:
P: Por que a adição de ácido aumenta a solubilidade do fosfato de cálcio?
R: A adição de ácido aumenta a solubilidade do Ca3(PO4)2 ao protonar os íons fosfato, tornando-os mais solúveis em água. Os íons fosfato protonados formam Ca3(PO4)2 ácido, que é mais solúvel que a forma neutra.
P: Quantos gramas de fósforo existem em 500,0 gramas de fosfato de cálcio?
R: A massa molar de Ca3(PO4)2 é 310,18 g/mol. O composto tem uma proporção fósforo/cálcio de 2:3, então a massa molar do fósforo é 30,97 g/mol. Existem, portanto, 81,62 gramas de fósforo em 500,0 gramas de Ca3(PO4)2.
P: O fosfato de cálcio é solúvel?
R: Ca3(PO4)2 tem baixa solubilidade em água, com solubilidade de produto de 1,8 x 10^-29. No entanto, a sua solubilidade pode ser aumentada pela adição de ácidos.
P: Qual é a porcentagem de oxigênio, em massa, no fosfato de cálcio?
R: A massa molar de Ca3(PO4)2 é 310,18 g/mol. A massa atômica do oxigênio é 16,00 g/mol e existem 8 átomos de oxigênio em um mol de Ca3(PO4)2. Portanto, a massa de oxigênio em um mol de Ca3(PO4)2 é 8 x 16,00 = 128,00 g. A massa de Ca3(PO4)2 é 310,18 g, então a porcentagem de oxigênio, em massa, é (128,00 g / 310,18 g) x 100% = 41,23%.
P: O Ca3 (PO4) 2 é solúvel em água?
R: Ca3(PO4)2 não é muito solúvel em água, com solubilidade de produto de 1,3 x 10^-33.
P: Qual é a massa molar do Ca3(PO4)2?
R: A massa molar de Ca3(PO4)2 é 310,18 g/mol.
P: O que é Ca3(PO4)2?
R: Ca3(PO4)2 é um composto químico composto por três íons Ca2+ e dois íons PO43-. É um pó branco, inodoro e insolúvel em água.
P: Qual é a massa da fórmula em gramas de Ca3(PO4)2?
R: A massa da fórmula em gramas de Ca3(PO4)2 é 310,18 g/mol.
