O fluoreto de zinco (ZnF2) é um composto químico. É composto de zinco e flúor. É utilizado em diversos setores, como odontológico e eletrônico, devido às suas propriedades únicas.
| Nome IUPAC | Fluoreto de zinco |
| Fórmula molecular | ZnF2 |
| Número CAS | 7783-49-5 |
| Sinônimos | Difluoreto de zinco, fluoreto de zinco (II) |
| InChI | InChI=1S/2FH.Zn/h2*1H;/q;;+2/p-2 |
Propriedades do fluoreto de zinco
Fórmula de fluoreto de zinco
A fórmula química do difluoreto de zinco é ZnF2. Esta fórmula significa que cada molécula de difluoreto de zinco consiste em um átomo de zinco (Zn) e dois átomos de flúor (F).
Massa molar de fluoreto de zinco
A massa molar do difluoreto de zinco (ZnF2) é de aproximadamente 103,38 g/mol. Este valor é calculado somando as massas atômicas de um átomo de zinco e dois átomos de flúor.
Ponto de ebulição do fluoreto de zinco
O difluoreto de zinco tem um ponto de ebulição de aproximadamente 872°C (1602°F). Esta é a temperatura na qual o composto muda de líquido para gás sob pressão atmosférica padrão.
Ponto de fusão de fluoreto de zinco
O ponto de fusão do difluoreto de zinco é de aproximadamente 872°C (1602°F). A esta temperatura, a forma sólida do difluoreto de zinco se transforma em líquido.
Densidade de fluoreto de zinco g/mL
A densidade do difluoreto de zinco é de aproximadamente 4,95 g/mL. Este valor representa a massa do composto por unidade de volume e indica seu peso.
Peso molecular do fluoreto de zinco
O peso molecular do difluoreto de zinco (ZnF2) é de aproximadamente 103,38 g/mol. Este valor representa a soma dos pesos atômicos de todos os átomos de uma molécula do composto.
Estrutura do fluoreto de zinco
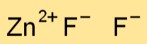
O difluoreto de zinco (ZnF2) possui uma estrutura cristalina na qual cada átomo de zinco é rodeado por quatro íons fluoreto dispostos em um arranjo tetraédrico. Este arranjo contribui para a estabilidade do composto.
Solubilidade do fluoreto de zinco
O difluoreto de zinco demonstra solubilidade limitada em água. É pouco solúvel, o que significa que apenas uma pequena quantidade do composto pode dissolver-se em água para formar uma solução. Esta característica é importante para diversas aplicações industriais e processos químicos.
| Aparência | Sólido branco |
| Gravidade Específica | 4,95g/cm³ |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 103,38 g/mol |
| Densidade | 4,95g/ml |
| Ponto de fusão | 872°C (1602°F) |
| Ponto de ebulição | 872°C (1602°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Solubilidade limitada |
| Solubilidade | Pouco solúvel, apenas uma pequena quantidade pode dissolver-se em água |
| Pressão de vapor | Não está bem definido |
| Densidade do vapor | Não está bem definido |
| pKa | Não aplicável |
| pH | Neutro |
Segurança e perigos do fluoreto de zinco
O difluoreto de zinco (ZnF2) apresenta certas considerações de segurança. É importante manusear este composto com cuidado. Evite inalação ou ingestão, pois pode causar irritação respiratória e gastrointestinal. Ao trabalhar com ZnF2, use equipamento de proteção individual adequado, como luvas e óculos de segurança, para evitar contato com a pele e os olhos. Em caso de contato acidental, enxaguar as áreas afetadas com água em abundância. Armazene o difluoreto de zinco longe de materiais incompatíveis e fontes de calor. Embora não seja muito tóxico, é aconselhável seguir procedimentos de manuseio adequados e garantir uma boa ventilação para minimizar riscos potenciais associados ao seu uso.
| Símbolos de perigo | Corrosivo, Irritante, Tóxico Agudo |
| Descrição de segurança | Manuseie com cuidado. Evite inalação e ingestão. Use equipamento de proteção. |
| Números de identificação da ONU | Não aplicável |
| Código SH | 28261900 |
| Classe de perigo | Não classificado |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Baixa toxicidade |
Métodos para a síntese de fluoreto de zinco
O difluoreto de zinco pode ser sintetizado por vários métodos. Uma abordagem comum envolve a reação entre o óxido de zinco (ZnO) e o ácido fluorídrico (HF) . Neste método, o ZnO é misturado ao HF, resultando na formação de difluoreto de zinco e água. Outro método envolve a reação entre carbonato de zinco (ZnCO3) e ácido fluorídrico. O carbonato de zinco reage com o HF para produzir difluoreto de zinco, dióxido de carbono e água.
Além disso, o difluoreto de zinco também pode ser preparado pela reação do metal zinco com gás flúor (F2) em altas temperaturas. Esta reação produz diretamente difluoreto de zinco com liberação de calor.
Além disso, podem ser utilizados métodos de precipitação, nos quais os sais solúveis de zinco reagem com sais solúveis de fluoreto para formar difluoreto de zinco insolúvel, que pode então ser separado e coletado.
É importante ter cautela durante estes processos de síntese devido à reatividade dos produtos químicos envolvidos. Devem ser utilizados equipamentos e medidas de segurança apropriados para garantir a síntese bem-sucedida e segura do difluoreto de zinco.
Usos do fluoreto de zinco
O difluoreto de zinco (ZnF2) encontra aplicações versáteis em diversas indústrias devido às suas propriedades únicas. Aqui estão seus principais usos:
- Assistência Odontológica: Fortalece o esmalte dos dentes e melhora a higiene bucal incorporando ZnF2 nas formulações de cremes dentais.
- Óptica e Revestimentos: Melhore as propriedades anti-reflexo das lentes e melhore a transmissão de luz usando ZnF2 em revestimentos ópticos.
- Eletrônicos: Integre ZnF2 em displays de transistor de filme fino (TFT) para criar filmes condutores transparentes.
- Fonte de íons de flúor: Use ZnF2 como fonte de íons de flúor em células eletrolíticas para ajudar a produzir metais reativos como o alumínio.
- Síntese química: Utilize ZnF2 como catalisador e agente de fluoração em diversas reações químicas para facilitar a síntese de produtos farmacêuticos e agroquímicos.
- Galvanização: Aplicar ZnF2 em processos de acabamento metálico em superfícies metálicas prontas para serem galvanizadas, melhorando a aderência e durabilidade.
- Janelas infravermelhas: Fabrica janelas de sensores infravermelhos e sistemas de imagem térmica utilizando ZnF2 devido à sua transparência na região infravermelha.
- Aplicações de laser: Use ZnF2 como meio de ganho de laser para contribuir com o desenvolvimento de lasers sintonizáveis para fins científicos e industriais.
- Crescimento de cristais: Incorporar ZnF2 em processos de crescimento de cristais para semicondutores e outros componentes eletrônicos.
- Pesquisa Química: Utilizar ZnF2 como reagente e reagente em diversas reações químicas em escala laboratorial, facilitando a exploração de novos compostos.
Essas diversas aplicações destacam a importância do difluoreto de zinco na tecnologia moderna, na fabricação e na pesquisa científica em vários campos.
Questões:
P: Qual é a fórmula química do fluoreto de zinco?
R: A fórmula química do difluoreto de zinco é ZnF2.
P: Qual é a fórmula do fluoreto de zinco (II)?
R: A fórmula do difluoreto de zinco (II) é ZnF2.
P: Qual é a fórmula do composto iônico formado a partir de íons zinco e fluoreto?
R: A fórmula do composto iônico formado a partir de Zn+2 e íons fluoreto é ZnF2.
P: O que pode acontecer devido a deficiências de zinco, iodo ou flúor?
R: As deficiências de Zn, iodo ou flúor podem levar a uma variedade de problemas de saúde, afetando o metabolismo, a função da tireoide e a saúde bucal.
P: Qual dos seguintes não possui uma RDA? A. ferro B. zinco c. iodo d. fluoreto
R: O flúor não tem uma dose dietética recomendada (RDA).
P: Como o fluoreto de zinco pode afetar um ser humano?
R: O difluoreto de zinco pode afetar humanos por ingestão, inalação ou potencial contato com a pele, possivelmente causando irritação ou toxicidade.
P: O ZnF2 é iônico ou molecular?
R: ZnF2 é um composto iônico.
P: Por que é ZnF2 e não ZnF?
R: ZnF2 indica que cada átomo de Zn está ligado a dois íons F, formando a estequiometria correta.
P: O ZnF2 e o NaOH formarão um precipitado?
R: Sim, ZnF2 e NaOH podem formar um precipitado branco de hidróxido de zinco (Zn(OH)2).
P: O ZnF2 é solúvel?
R: O ZnF2 é pouco solúvel em água.
P: Qual é o nome do composto com a fórmula ZnF2?
R: O composto com a fórmula ZnF2 é denominado difluoreto de zinco.
Q: O Ksp do ZnF2 é 3,0 × 10⁻² a 25°C. O que é ΔG°?
R: O valor de ΔG° pode ser calculado com base no valor Ksp e na temperatura fornecidos usando a equação termodinâmica apropriada.
P: O que é ZnF2?
R: ZnF2 é a fórmula química do difluoreto de zinco, um composto de zinco e flúor.
P: Quantos moles existem no ZnF2?
R: O número de moles em ZnF2 depende da massa dada e da massa molar do composto.
