O fluoreto de sódio (NaF) é um composto químico usado para prevenir a cárie dentária. Fortalece o esmalte dos dentes, remineralizando-o e inibindo o crescimento de bactérias orais nocivas.
| Nome da IUPAC | Fluoreto de Sódio |
| Fórmula molecular | NaF |
| Número CAS | 7681-49-4 |
| Sinônimos | Monofluoreto de sódio, Fluoreto de sódio anidro, Fluoreto monossódico, Fluoreto de sódio, |
| Solutia SFL, Fluka 01178, 3M ESPE 12104, Puriss. fluoreto de sódio, fluoreto de sódio extrapuro | |
| InChI | InChI=1S/FH.Na/h1H;/q;+1/p-1 |
Propriedades do fluoreto de sódio
Fórmula de fluoreto de sódio
A fórmula química do fluoreto de sódio é NaF. Isso significa que cada molécula de NaF consiste em um íon Na+ e um íon F-. A fórmula é importante em química porque fornece informações sobre os tipos e o número de átomos ou íons em uma molécula de uma substância.
Massa molar de fluoreto de sódio
A massa molar do NaF é 41,99 g/mol. É a soma das massas atômicas de um átomo de sódio e de um átomo de flúor, que são 22,99 g/mol e 19,00 g/mol, respectivamente. A massa molar é uma propriedade importante em química porque permite calcular o número de moles de uma substância com base na sua massa e vice-versa.
Ponto de ebulição do fluoreto de sódio
O ponto de ebulição do NaF é 1705°C (3101°F). Esta é a temperatura na qual a forma líquida do NaF muda para a forma gasosa. O NaF tem um ponto de ebulição relativamente alto em comparação com outros compostos de F devido à sua forte ligação iônica entre os íons Na+ e os íons F-.
Ponto de fusão do fluoreto de sódio
O ponto de fusão do NaF é 993°C (1.819°F). Esta é a temperatura na qual a forma sólida do NaF muda para a forma líquida. O NaF tem um ponto de fusão relativamente alto devido à sua forte ligação iônica entre os íons Na+ e os íons F-.
Densidade de fluoreto de sódio g/mL
A densidade do NaF é 2,79 g/mL. Isto significa que um mililitro de NaF pesa 2,79 gramas. A densidade é uma propriedade importante de uma substância porque pode ser usada para determinar a massa de uma substância com base no seu volume, ou o volume de uma substância com base na sua massa.
Peso molecular do fluoreto de sódio
O peso molecular do NaF é 41,99 g/mol. É a soma dos pesos atômicos de sódio e flúor em uma molécula de NaF. O peso molecular é importante em química porque ajuda a calcular várias propriedades de uma substância, como densidade e molaridade.
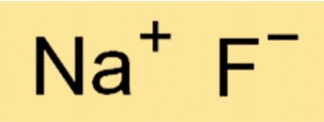
Estrutura do fluoreto de sódio
O NaF possui uma estrutura cristalina em sua forma sólida. Consiste em íons Na+ e íons F- dispostos em uma estrutura de rede cúbica. Os íons Na+ ocupam os cantos do cubo, enquanto os íons fluoreto ocupam os centros das faces do cubo. Este arranjo resulta em uma forte ligação iônica entre os íons Na+ e os íons F-.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 2,79g/cm³ |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 41,99 g/mol |
| Densidade | 2,79g/ml |
| Ponto de fusão | 993°C (1.819°F) |
| Ponto de ebulição | 1705°C (3101°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 4,24g/100ml (20°C) |
| Solubilidade | Solúvel em álcool e éter |
| Pressão de vapor | 1mmHg (713°C) |
| Densidade do vapor | 2,9 (ar = 1) |
| pKa | 7.2 |
| pH | 7,6-8,4 (solução aquosa 0,1 M) |
Segurança e perigos do fluoreto de sódio
O NaF tem alguns problemas de segurança e perigo. É tóxico se ingerido em grandes quantidades e pode causar náuseas, vômitos, diarreia e dores abdominais. A inalação de poeira NaF pode causar irritação respiratória e danos aos pulmões. Também pode causar irritação nos olhos e na pele em contato. O NaF também é corrosivo para alguns metais e pode reagir violentamente com ácidos fortes. Procedimentos adequados de manuseio, armazenamento e descarte devem ser seguidos ao trabalhar com NaF para evitar esses perigos. É importante sempre usar equipamento de proteção individual adequado ao manusear o NaF.
| Símbolos de perigo | T,N |
| Descrição de segurança | Evite ingestão, inalação, contato com a pele e os olhos. Use EPI apropriado. Siga os procedimentos seguros de manuseio, armazenamento e descarte. |
| Números de identificação da ONU | UN1690 (para sólido) |
| Código SH | 2826.12.00 |
| Classe de perigo | 6.1 (Substâncias tóxicas) |
| Grupo de embalagem | II |
| Toxicidade | Tóxico se ingerido ou inalado em grandes quantidades. Pode causar irritação no trato respiratório, olhos e pele. Corrosivo para certos metais. |
Métodos para a síntese de fluoreto de sódio
Os químicos usam vários métodos para sintetizar fluoreto de sódio (NaF).
Um método comum é reagir o ácido fluorídrico com hidróxido de sódio ou carbonato de sódio . Para remover água ou impurezas, alguém seca e aquece o produto resultante.
Outro método envolve a reação de NaCl com HF , que produz NaF e cloreto de hidrogênio como subprodutos. Este método é menos comum devido a questões de segurança associadas ao manuseio de fluoreto de hidrogênio.
Outra forma de sintetizar NaF é reagir o carbonato de sódio com o gás HF . A reação produz NaF, dióxido de carbono e vapor de água. As aplicações industriais geralmente usam esse método para produzir NaF.
Além disso, o NaF pode ser sintetizado aquecendo o gás flúor com sódio metálico. No entanto, este método é raro devido à alta reatividade do sódio e do flúor. Além disso, este método requer equipamento especializado e manuseio cuidadoso devido ao risco de explosão.
Usos do fluoreto de sódio
O NaF tem diversos usos em diferentes setores. Aqui estão alguns usos comuns do NaF:
- Higiene dentária: Cremes dentais, enxaguatórios bucais e tratamentos odontológicos adicionam NaF para prevenir cáries dentárias e melhorar a saúde bucal.
- Tratamento de Água: Adicionado à água potável em algumas áreas para prevenir cáries dentárias.
- Aplicações industriais: Utilizado como fundente na produção de alumínio e na produção de vidro e cerâmica para diminuir o ponto de fusão e melhorar a transparência.
- Metalurgia: Utilizada no refino e processamento de metais, por exemplo, para remoção de impurezas na produção de aço e alumínio.
- Pesticida: Utilizado como pesticida no combate a roedores e insetos.
- Química: Usado como fonte de íons fluoreto em diversas reações químicas.
- Indústria nuclear: Usado como refrigerante e agente de transferência de calor em alguns reatores nucleares.
- Produtos farmacêuticos: utilizados na fabricação de determinados medicamentos, como antidepressivos e antiinflamatórios.
Questões:
P: O fluoreto de sódio na pasta de dente faz mal à saúde?
R: O NaF encontrado na pasta de dente é geralmente considerado seguro quando usado conforme as instruções. Ajuda a prevenir cáries dentárias e é aprovado por associações dentárias em todo o mundo. No entanto, a ingestão excessiva de pasta de dente pode causar dores de estômago e outros problemas de saúde.
P: Uma solução diluída ou concentrada de fluoreto de sódio teria um ponto de ebulição mais alto?
R: Uma solução concentrada de NaF teria um ponto de ebulição mais alto do que uma solução diluída devido ao aumento do número de partículas de soluto na solução, o que aumenta o ponto de ebulição através do efeito de aumento do ponto de ebulição.
P: Quantos gramas existem em 4,5 moles de fluoreto de sódio?
R: A massa molar do NaF é 41,99 g/mol, então 4,5 moles de NaF seriam 188,96 gramas.
P: O fluoreto de sódio é iônico ou covalente?
R: O NaF é um composto iônico, formado pela atração eletrostática entre o íon Na+ e o íon F-.
P: Qual é a maneira correta de representar o composto iônico fluoreto de sódio?
R: A forma correta de representar este composto iônico é NaF, onde Na representa Na+ e F representa F-.
P: Qual é o nome do composto com a fórmula NaF?
R: O nome do composto com a fórmula NaF é fluoreto de sódio.
P: O NaF é um ácido ou uma base?
R: NaF é um sal formado a partir da reação de neutralização entre uma base forte (hidróxido de sódio) e um ácido fraco (ácido fluorídrico). Não é ácido nem base, mas pode sofrer hidrólise para formar uma solução básica.
