O fluoreto de cobre (CuF2) é um composto feito de cobre e flúor. Apresenta uma cor azul esverdeada e encontra aplicações em diversas indústrias, incluindo eletrônica e catálise.
| Nome IUPAC | Fluoreto de cobre (II) |
| Fórmula molecular | CuF2 |
| Número CAS | 7789-19-7 |
| Sinônimos | Fluoreto cúprico, Difluoreto de cobre |
| InChI | InChI=1S/2FH.Cu/h2*1H;/q;;+2/p-2 |
Propriedades do fluoreto de cobre
Fórmula de fluoreto de cobre
A fórmula do difluoreto de cobre é CuF2. Consiste em um átomo de cobre (Cu) e dois átomos de flúor (F). Este composto iônico forma uma estrutura cristalina estável devido à atração eletrostática entre o íon cobre carregado positivamente e os íons fluoreto carregados negativamente.
Massa molar de fluoreto de cobre
A massa molar do difluoreto de cobre (CuF2) é calculada somando as massas atômicas de seus elementos constituintes. O cobre tem massa molar de aproximadamente 63,55 g/mol e o flúor tem massa molar de aproximadamente 18,99 g/mol. Somando-os, obtemos que a massa molar do difluoreto de cobre é de aproximadamente 101,09 g/mol.
Ponto de ebulição do fluoreto de cobre
O difluoreto de cobre não possui ponto de ebulição bem definido, pois sofre decomposição antes de atingir o ponto de ebulição. Em altas temperaturas, o difluoreto de cobre começa a se decompor em difluoreto de cobre (CuF) e gás flúor (F2). Portanto, é considerado termicamente instável.
Ponto de fusão do fluoreto de cobre
O difluoreto de cobre tem um ponto de fusão de aproximadamente 840°C (1544°F). A esta temperatura, os cristais sólidos de difluoreto de cobre absorvem energia suficiente para fazer a transição para um estado fundido, permitindo que sejam usados em uma variedade de aplicações de alta temperatura.
Densidade de fluoreto de cobre g/mL
A densidade do difluoreto de cobre é de aproximadamente 4,23 g/mL. Este valor de densidade indica que o difluoreto de cobre é um material relativamente denso, que pode ser útil em aplicações específicas onde é necessária alta densidade.
Peso molecular do fluoreto de cobre
O peso molecular do difluoreto de cobre (CuF2) é de aproximadamente 101,09 g/mol. É calculado somando os pesos atômicos do cobre e dois átomos de flúor presentes na fórmula.
Estrutura do fluoreto de cobre
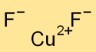
O difluoreto de cobre adota uma estrutura cristalina, formando um arranjo em rede de cátions Cu2+ e ânions F-. Os cátions de cobre estão rodeados por seis íons de fluoreto e cada íon de fluoreto está em contato com três íons de cobre.
Solubilidade do fluoreto de cobre
O difluoreto de cobre tem baixa solubilidade em água. Forma sais pouco solúveis que liberam íons Cu2+ e F- na solução. Esta propriedade é importante em vários processos e aplicações químicas, incluindo síntese inorgânica e aplicações eletroquímicas.
| Aparência | Sólido azul esverdeado |
| Gravidade Específica | 4,23 g/ml |
| Cor | azul-esverdeado |
| Cheiro | Inodoro |
| Massa molar | 101,09 g/mol |
| Densidade | 4,23g/cm³ |
| Ponto de fusão | 840°C (1544°F) |
| Ponto de ebulição | Decomposto |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Fraco, forma sais pouco solúveis |
| Solubilidade | Pouco solúvel |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | Não aplicável |
| pH | Neutro |
Segurança e perigos do fluoreto de cobre
O difluoreto de cobre levanta várias considerações de segurança e perigo. O contato direto com o composto pode causar irritação na pele e nos olhos. A inalação de poeira ou vapores pode causar problemas respiratórios. Quando aquecido, pode liberar gás flúor tóxico, que é prejudicial se inalado. Portanto, ventilação adequada e equipamento de proteção individual devem ser utilizados ao manusear difluoreto de cobre. Além disso, é essencial evitar a ingestão, pois pode causar problemas gastrointestinais. O composto deve ser armazenado em recipientes fechados, longe de materiais incompatíveis para evitar reações. Protocolos de segurança e práticas de manuseio adequados são essenciais para minimizar os riscos associados ao difluoreto de cobre.
| Símbolos de perigo | Irritante |
| Descrição de segurança | Causa irritação na pele e nos olhos. Nocivo se inalado. Pode liberar gás flúor tóxico quando aquecido. Evite ingerir. Use ventilação e equipamento de proteção adequados. |
| Números de identificação da ONU | N / D |
| Código SH | 2826.92.00 |
| Classe de perigo | 6.1 (Substâncias tóxicas) |
| Grupo de embalagem | III |
| Toxicidade | Tóxico |
Métodos de síntese de fluoreto de cobre
Existem vários métodos para sintetizar difluoreto de cobre. Uma abordagem comum é adicionar óxido de cobre (CuO) ou carbonato de cobre (CuCO3) a um recipiente e agitar cuidadosamente enquanto adiciona ácido fluorídrico (HF) ao recipiente. A reação continua, produzindo difluoreto de cobre e água como subprodutos.
Outro método envolve a reação de cobre metálico ou pó de cobre com gás flúor (F2) em altas temperaturas. Este processo requer um manuseio cuidadoso devido à reatividade do gás flúor. Forma difluoreto de cobre diretamente através da combinação de átomos de cobre e flúor.
Além disso, a preparação do difluoreto de cobre pode ocorrer pela reação do cloreto de cobre (II) (CuCl2) com fluoreto de sódio (NaF) em solução aquosa. A reação produz difluoreto de cobre e também cloreto de sódio como subproduto.
Estes métodos de síntese requerem medidas de segurança e equipamentos adequados devido à reatividade de alguns dos produtos químicos envolvidos. O controle preciso das condições de reação é crucial para obter altos rendimentos de difluoreto de cobre puro.
Usos do fluoreto de cobre
O difluoreto de cobre encontra uma variedade de aplicações valiosas devido às suas propriedades e características únicas. Aqui estão alguns usos principais:
- Eletrônicos: O difluoreto de cobre é usado na indústria de semicondutores como fonte de íons de cobre para processos de deposição de filmes finos. É pioneira na fabricação de dispositivos eletrônicos e circuitos integrados.
- Catálise: Atua como catalisador em diversas reações químicas, inclusive na síntese de compostos orgânicos e em processos industriais como reações de fluoração.
- Fonte de flúor: O difluoreto de cobre é usado para produzir gás flúor (F2) por decomposição em alta temperatura, essencial para diversas aplicações industriais.
- Cerâmica e Vidro: O composto é utilizado como aditivo na fabricação de cerâmica e vidro para modificar as propriedades do material e melhorar seu desempenho.
- Materiais odontológicos: O difluoreto de cobre é incorporado em produtos odontológicos, como cremes dentais e enxaguatórios bucais, para aumentar suas propriedades anticáries e antibacterianas.
- Revestimentos: É utilizado em revestimentos especiais, como revestimentos antirreflexos para dispositivos ópticos e revestimentos protetores para superfícies metálicas.
- Retardadores de chama: O difluoreto de cobre é utilizado como aditivo em materiais retardadores de chama, ajudando a reduzir a inflamabilidade de diversos produtos.
- Reagente Químico: Em laboratórios e pesquisas, o difluoreto de cobre é utilizado como reagente em reações e análises químicas específicas.
A versatilidade do difluoreto de cobre o torna valioso em todos os setores, desde a eletrônica até a saúde, onde suas propriedades exclusivas são aproveitadas para melhorar o desempenho e a segurança. No entanto, o manuseio adequado e as precauções de segurança são essenciais devido à sua reatividade e riscos potenciais.
Questões:
P: Qual é a fórmula da massa do fluoreto de cobre (II)?
R: A massa da fórmula do difluoreto de cobre (II) (CuF2) é de aproximadamente 101,09 g/mol.
P: Qual das alternativas a seguir é a fórmula correta para fluoreto de cobre (II)?
R: A fórmula correta para o difluoreto de cobre (II) é CuF2.
P: O cobre limpa o flúor?
R: Não, o cobre não limpa o difluoreto. O cobre não tem a capacidade de remover o difluoreto da água.
P: Qual é o composto covalente de NaCl, KCl, CuF2 e CF4?
R: O composto covalente é CF4 (tetrafluoreto de carbono).
P: Quando uma solução aquosa de CuF2 é eletrolisada, o que é formado nos eletrodos?
R: No ânodo forma-se oxigênio gasoso (O2) e no cátodo cobre metálico (Cu).
P: Qual é o nome de CuF2 no sistema Stock?
R: O nome do CuF2 no sistema Stock é difluoreto de cobre (II).
P: Qual é a carga do íon cobre no composto CuF2?
R: A carga do íon cobre em CuF2 é +2.
P: O CuF2 é iônico ou molecular?
R: CuF2 é um composto iônico.
P: Qual é a carga do composto iônico CuF2?
R: O composto iônico CuF2 é neutro.
P: Qual é o nome do composto com a fórmula CuF2?
R: O nome do composto com fórmula CuF2 é difluoreto de cobre (II).
