O nitrato de ferro III é um composto químico. É formado pela combinação de íons de ferro com íons nitrato. É comumente usado em aplicações industriais e como reagente de laboratório.
| Nome IUPAC | Nitrato de ferro (III) |
| Fórmula molecular | Fe(NO3)3 |
| Número CAS | 10421-48-4 |
| Sinônimos | Nitrato férrico, trinitrato de ferro, sal de ferro (III) de ácido nítrico |
| InChI | InChI=1S/Fe.3NO3/c;3 2-1(3)4/q+3;3 -1 |
Propriedades do nitrato de ferro (III)
Fórmula de nitrato de ferro (III)
A fórmula do nitrato de ferro III é Fe(NO3)3. Consiste em um íon de ferro (Fe) e três íons nitrato (NO3). Esta fórmula representa a combinação do cátion ferro com os ânions nitrato.
Nitrato de Ferro(III) Massa molar
A massa molar do nitrato de ferro pode ser calculada somando as massas atômicas de seus elementos constituintes. O ferro (Fe) tem massa molar de 55,845 g/mol, enquanto cada íon nitrato (NO3) tem massa molar de 62,0049 g/mol. A adição desses valores dá uma massa molar de aproximadamente 241,86 g/mol para o nitrato de ferro.
Ponto de ebulição do nitrato de ferro (III)
O nitrato de ferro não possui um ponto de ebulição específico. Quando aquecido, ele se decompõe em vários óxidos de nitrogênio e, por fim, forma óxido de ferro. A temperatura de decomposição depende de fatores como concentração e presença de outras substâncias.
Ponto de fusão do nitrato de ferro (III)
O ponto de fusão do nitrato de ferro é de aproximadamente 47°C (117°F). A esta temperatura, o composto sólido passa para o estado líquido. É importante notar que o ponto de fusão pode variar ligeiramente dependendo de fatores como impurezas ou da composição exata do composto.
Densidade de nitratos de ferro (III) g/mL
A densidade do Fe(NO3)3 é de aproximadamente 1,68 g/mL. A densidade representa a massa por unidade de volume de uma substância. Neste caso indica a massa de Fe(NO3)3 por mililitro do composto.
Peso molecular do nitrato de ferro (III)
O peso molecular do nitrato de ferro é de aproximadamente 241,86 g/mol. O peso molecular refere-se à soma dos pesos atômicos de todos os átomos de uma molécula.
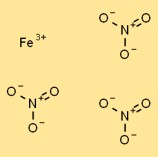
Estrutura do nitrato de ferro (III)
O nitrato de ferro possui estrutura cristalina em sua forma sólida. Consiste em cátions Fe3+ rodeados por ânions nitrato coordenados (NO3-). Os cátions de ferro são mantidos juntos por ligações iônicas, enquanto os ânions nitrato são atraídos pelos cátions por forças eletrostáticas.
Solubilidade de nitratos de ferro (III)
O nitrato de ferro é muito solúvel em água. Dissolve-se facilmente em água para formar uma solução límpida e amarelo pálido. A solubilidade do nitrato de ferro em outros solventes ou substâncias pode variar.
| Aparência | Cristais amarelo pálido |
| Gravidade Específica | 1,68 |
| Cor | Amarelo claro |
| Cheiro | Inodoro |
| Massa molar | 241,86 g/mol |
| Densidade | 1,68 g/ml |
| Ponto de fusão | 47°C (117°F) |
| Ponto de ebulição | Decomposto |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel |
| Solubilidade | Solúvel em água e solventes polares |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | Não disponível |
| pH | Ácido |
Segurança e perigos do nitrato de ferro (III)
O nitrato de ferro apresenta alguns riscos de segurança e deve-se ter cuidado ao manuseá-lo. É considerado irritante para a pele, olhos e aparelho respiratório. O contato direto com o composto deve ser evitado e devem ser usados equipamentos de proteção, como luvas e óculos de proteção. A ingestão ou inalação de nitrato de ferro pode causar efeitos nocivos e, portanto, não deve ser ingerido ou inalado. É importante trabalhar com este composto em área bem ventilada para minimizar o risco de inalação. Em caso de exposição ou ingestão acidental, deve-se procurar atendimento médico imediato. Práticas adequadas de armazenamento e manuseio devem ser seguidas para garantir a segurança.
| Símbolos de perigo | Xi,O |
| Descrição de segurança | Causa irritação na pele e nos olhos. Pode causar irritação respiratória. Perigoso se ingerido. |
| Números de identificação da ONU | ONU 1466 (Anidro) |
| Código SH | 28342990 |
| Classe de perigo | 5.1 (Agente oxidante) |
| Grupo de embalagem | II |
| Toxicidade | Toxicidade moderada |
Métodos para a síntese de nitrato de ferro (III)
O nitrato de ferro pode ser sintetizado por vários métodos, sendo o método comum dissolver o óxido de ferro (III) (Fe2O3) em ácido nítrico concentrado (HNO3). Essa reação resulta na formação de nitrato de ferro, representado pela equação:
O ácido nítrico concentrado dissolve o óxido de ferro(III) , produzindo Fe(NO3)3 e também produzindo água:
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O.
Outro método envolve a combinação de ferro metálico com uma mistura de ácido nítrico e peróxido de hidrogênio, que oxida o ferro para formar nitrato de ferro. Esta reação bem conhecida merece o nome de método “água régia”.
A adição de ferro metálico a uma mistura de ácido nítrico e peróxido de hidrogênio leva à produção de nitrato de ferro e água:
2Fe + 8HNO3 + 6H2O2 → 2Fe(NO3)3 + 6H2O.
É crucial ter cautela ao realizar essas reações devido à natureza corrosiva e oxidante dos produtos químicos envolvidos. É necessário seguir medidas de segurança adequadas, como usar equipamentos de proteção e trabalhar em área bem ventilada.
Fornecedores químicos respeitáveis oferecem nitrato de ferro disponível comercialmente, garantindo uma fonte consistente e confiável do composto para diversas aplicações em indústrias e laboratórios.
Usos do nitrato de ferro (III)
O nitrato de ferro tem diversos usos práticos em diversas indústrias e laboratórios. Aqui estão algumas aplicações principais do nitrato de ferro:
- Catalisador industrial: Vários processos industriais, incluindo a produção de náilon e outros polímeros, utilizam nitrato de ferro como catalisador.
- Tingimento e Pigmentos: A indústria de tingimento e pigmentação utiliza nitrato de ferro como mordente para fixar corantes em tecidos e melhorar a solidez da cor.
- Ácido: As indústrias metalúrgica e eletrônica usam nitrato de ferro como ácido para criar padrões e desenhos complexos em superfícies metálicas.
- Reagente de Laboratório: O nitrato de ferro serve como um reagente de laboratório comum para diversas reações químicas e experimentos, especialmente para a síntese de outros compostos.
- Agente Oxidante: O nitrato de ferro atua como agente oxidante em reações químicas, inclusive na síntese orgânica, devido às suas fortes propriedades oxidantes.
- Tratamento de Água: O nitrato de ferro é útil em processos de tratamento de água para remover impurezas, como fosfatos e sulfetos, de águas residuais industriais.
- Fotografia: Alguns processos fotográficos, nomeadamente a preparação de emulsões fotográficas à base de ferro, utilizam nitrato de ferro.
- Química Analítica: O nitrato de ferro encontra aplicações em técnicas de química analítica, como análise colorimétrica, para detectar e quantificar substâncias específicas.
- Preservação de madeira: Os tratamentos de preservação de madeira usam nitrato de ferro como ingrediente ativo para proteger a madeira do apodrecimento por fungos e infestações de insetos.
- Aplicações farmacêuticas: A formulação de certos produtos farmacêuticos e medicamentos envolve o uso de nitrato de ferro.
É importante observar que o manuseio adequado e as precauções de segurança devem ser seguidas ao trabalhar com nitrato de ferro devido à sua natureza corrosiva e oxidante.
Questões:
P: O nitrato de ferro (III) é inflamável?
R: Não, o nitrato de ferro não é inflamável.
P: Quais são as preocupações de segurança e manuseio do nitrato de ferro (III)?
R: As preocupações de segurança incluem irritação na pele, olhos e trato respiratório. Portanto, deve ser manuseado com equipamentos e precauções de proteção adequados.
P: Qual fórmula representa o nitrato de ferro (III)?
R: A fórmula do nitrato de ferro é Fe(NO3)3.
P: Qual é a fórmula do nitrato de ferro (III)?
R: A fórmula do nitrato de ferro (III) é Fe (NO3)3.
P: Qual é a massa molar do nitrato de ferro (III)?
R: A massa molar do Fe(NO3)3 é aproximadamente 241,86 g/mol.
P: O hidróxido de ferro é solúvel em água?
R: O hidróxido de ferro é pouco solúvel em água.
P: Ele reage com nitrato de ferro (III)?
R: Não, o cálcio (Ca) geralmente não reage com o Fe(NO3)3.
P: Com que parte da aspirina o nitrato de ferro (III) reage?
R: O nitrato de ferro (III) reage com o grupo carboxilato (-COO-) presente na molécula de aspirina.
P: Qual é a massa molecular do nitrato de ferro (III)?
R: A massa molecular do Fe(NO3)3 é de aproximadamente 241,86 g/mol.
P: O Al reage com o nitrato de ferro (III)?
R: Sim, o alumínio (Al) pode reagir com Fe(NO3)3 para formar nitrato de alumínio e ferro metálico.
P: Quantos mols de nitrato são dissolvidos em 50,0 g de água em uma solução 3,80 M de nitrato de ferro (III)?
R: Para determinar os moles de nitrato, é necessário o volume da solução, pois apenas a molaridade e a massa de água são fornecidas.
