O etóxido de sódio é uma base forte formada pela reação do sódio com o etanol. É usado em síntese orgânica para facilitar reações como esterificação e desprotonação.
| Nome IUPAC | Etóxido de sódio |
| Fórmula molecular | C2H5NaO |
| Número CAS | 141-52-6 |
| Sinônimos | Etanol, sal de sódio; Etóxido de sódio; Etil sódico; Etilato; Alcoolato etílico de sódio |
| InChI | InChI=1S/C2H5O.Na/c1-2-3;/h2-3H,1H3;/q-1;+1 |
Propriedades do etóxido de sódio
Fórmula de Etóxido de Sódio
A fórmula química do etóxido de sódio é C2H5NaO. Consiste em dois átomos de carbono (C), cinco átomos de hidrogênio (H), um átomo de sódio (Na) e um átomo de oxigênio (O). A fórmula representa a proporção de átomos presentes em uma molécula de etóxido de sódio.
Massa molar de etóxido de sódio
A massa molar do etóxido de sódio é calculada somando as massas atômicas de todos os átomos de sua fórmula. O sódio (Na) tem massa molar de 22,99 g/mol, o carbono (C) tem massa molar de 12,01 g/mol, o hidrogênio (H) tem massa molar de 1,01 g/mol mol e o oxigênio (O) tem massa molar massa de 1,01 g/mol. massa de 16,00 g/mol. A sua adição dá uma massa molar de aproximadamente 68,06 g/mol para o etóxido de sódio.
Ponto de ebulição do etóxido de sódio
O etóxido de sódio tem um ponto de ebulição de aproximadamente 90-95°C (194-203°F). Esta temperatura indica o ponto em que o etóxido de sódio muda de uma fase líquida para uma fase gasosa quando aquecido sob pressão atmosférica padrão.
Ponto de fusão do etóxido de sódio
O ponto de fusão do etóxido de sódio é de aproximadamente 260-270°C (500-518°F). Isso significa a temperatura na qual o etóxido de sódio sólido muda para o estado líquido.
Densidade de etóxido de sódio g/mL
O etóxido de sódio tem uma densidade de aproximadamente 0,868 g/mL. A densidade refere-se à massa de uma substância por unidade de volume e pode ser usada para determinar seu peso ou leveza relativa em comparação com um volume igual de água.
Peso molecular do etóxido de sódio
O peso molecular do etóxido de sódio, também chamado de peso molecular, é de aproximadamente 68,06 g/mol. É calculado somando as massas atômicas de todos os átomos presentes em uma molécula de etóxido de sódio.
Estrutura do etóxido de sódio
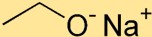
O etóxido de sódio possui uma estrutura na qual o átomo de sódio (Na) está ligado ao átomo de oxigênio (O) por uma ligação iônica. O grupo etóxido, composto por dois átomos de carbono (C) e cinco átomos de hidrogênio (H), está ligado ao átomo de sódio.
Solubilidade do etóxido de sódio
O etóxido de sódio é altamente solúvel em solventes polares como etanol (C2H5OH) e outros solventes orgânicos. Dissolve-se facilmente nesses solventes formando uma solução límpida e incolor, facilitando seu uso como reagente em diversas reações orgânicas.
| Aparência | Sólido incolor |
| Gravidade Específica | 0,868g/ml |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 68,06 g/mol |
| Densidade | 0,868g/ml |
| Ponto de fusão | 260-270°C (500-518°F) |
| Ponto de ebulição | 90-95°C (194-203°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Reage com água |
| Solubilidade | Solúvel em etanol (C2H5OH) e outros solventes orgânicos |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | Não disponível |
| pH | Básico (alcalino) |
Segurança e perigos do etóxido de sódio
O etóxido de sódio apresenta vários riscos de segurança e deve-se ter cuidado ao manuseá-lo. É uma substância corrosiva que pode causar queimaduras graves na pele, olhos e aparelho respiratório. O contato direto deve ser evitado e devem ser usadas luvas, óculos de proteção e roupas de proteção. Ele reage violentamente com a água, liberando gás hidrogênio inflamável, e deve ser armazenado longe da umidade. O etilato de sódio também pode reagir vigorosamente com o ar, resultando potencialmente em incêndio ou explosão. Uma boa ventilação é crucial para evitar a acumulação de vapores. Além disso, é importante manusear o etóxido de sódio em um laboratório bem equipado e com pessoal treinado para minimizar os riscos e garantir a segurança.
| Símbolos de perigo | Corrosivo |
| Descrição de segurança | – Causa queimaduras graves<br>- Reage violentamente em contato com a água<br>- Armazenar longe da umidade<br>- Manusear com cuidado<br>- Usar equipamento de proteção<br>- Armazenar em local seco<br>- Garantir boa ventilação |
| Números de identificação da ONU | ONU2922 |
| Código SH | 2905.19.00 |
| Classe de perigo | 8 (Substâncias corrosivas) |
| Grupo de embalagem | II |
| Toxicidade | Tóxico se ingerido ou inalado |
Métodos para a síntese de etóxido de sódio
Existem vários métodos para sintetizar etóxido de sódio.
Uma forma de sintetizar o etóxido de sódio envolve a reação entre o sódio metálico e o etanol . O sódio metálico sofre uma reação redox com o etanol anidro, resultando na formação de etóxido de sódio. Para realizar a reação, podem-se adicionar pequenos pedaços de sódio metálico ao etanol absoluto e refluxar a mistura sob condições controladas.
Outro método envolve a reação entre hidróxido de sódio (NaOH) e etanol . O hidróxido de sódio é dissolvido em etanol e a mistura é aquecida, o que promove a reação para dar etóxido de sódio. Os químicos geralmente usam esse método quando não preferem a reação direta entre o sódio metálico e o etanol.
Como alternativa, eles podem preparar etóxido de sódio fazendo reagir etanol com carbonato de sódio (Na2CO3). Dissolva o carbonato de sódio em etanol , aqueça e agite a mistura. Este processo leva à formação de etóxido de sódio.
Deve-se notar que estes métodos de síntese exigem o cumprimento estrito das precauções de segurança devido à reatividade dos produtos químicos envolvidos. O manuseio adequado de substâncias inflamáveis, o uso de equipamentos de proteção e a condução de reações em áreas bem ventiladas são essenciais para a segurança pessoal e para o sucesso da síntese de etóxido de sódio.
Usos do etóxido de sódio
O etóxido de sódio encontra diversas aplicações devido à sua reatividade e forte natureza básica. Aqui estão alguns usos comuns:
- Síntese Orgânica: O etóxido de sódio serve amplamente como uma base sólida na síntese orgânica. Facilita reações como processos de esterificação, condensação e desprotonação.
- Reagente Alcóxido: Serve como um reagente alcóxido, que pode reagir com vários compostos orgânicos para formar alcóxidos. Esses alcóxidos são intermediários cruciais em muitas reações orgânicas.
- Catalisador: O etóxido de sódio atua como catalisador em diversas reações químicas. Promove a conversão de compostos orgânicos, como álcoois e ésteres, em seus correspondentes éteres ou produtos de esterificação.
- Agente desidratante: Desidrata compostos orgânicos removendo moléculas de água, facilitando assim a síntese de produtos anidros.
- Polimerização: O etóxido de sódio participa de reações de polimerização, incluindo a produção de tereftalato de polietileno (PET) e outros polímeros de poliéster.
- Fabricação farmacêutica: Encontra aplicações na indústria farmacêutica para a síntese de diversos compostos farmacêuticos incluindo ésteres, éteres e intermediários.
- Produção de Biodiesel: O processo de transesterificação utiliza etilato de sódio para converter óleos vegetais ou gorduras animais em biodiesel, um combustível renovável e ecologicamente correto.
- Reagente de Laboratório: Os pesquisadores geralmente usam etóxido de sódio como reagente para reações orgânicas e em configurações experimentais.
Questões:
P: O etóxido de sódio é baseado?
R: Sim, o etóxido de sódio é uma base.
P: O etóxido de sódio é uma base forte ou fraca?
R: O etóxido de sódio é uma base forte.
P: O que você esperaria se o etóxido de sódio fosse adicionado à água?
R: Se o etóxido de sódio for adicionado à água, ele reagirá vigorosamente, liberando gás hidrogênio e formando hidróxido de sódio.
P: O etóxido de sódio é uma base forte ou fraca?
R: O etóxido de sódio é uma base forte.
P: O etóxido de sódio é um nucleófilo forte?
R: Sim, o etóxido de sódio é um nucleófilo forte.
P: Qual dos seguintes sofre mais facilmente uma reação E2 com etóxido de sódio?
R: O composto com um grupo de saída primário ou secundário sofreria mais facilmente uma reação E2 com etóxido de sódio.
P: O etóxido de sódio é um nucleófilo forte?
R: Sim, o etóxido de sódio é um nucleófilo forte.
P: O etóxido de sódio é baseado?
R: Sim, o etóxido de sódio é uma base.
P: Qual dos seguintes sofre mais facilmente uma reação E2 com etóxido de sódio (NaOCH2CH3)?
R: Um composto com um grupo de saída primário ou secundário sofreria mais facilmente uma reação E2 com etóxido de sódio.
P: O etóxido de sódio é inflamável?
R: O etóxido de sódio em si não é inflamável, mas reage violentamente com a água, liberando gás hidrogênio inflamável.
P: O que, quando combinado com o etanol, produz etóxido de sódio e hidrogênio?
R: A combinação de sódio metálico e etanol produz etóxido de sódio e gás hidrogênio.
P: O que você esperaria se o etóxido de sódio fosse adicionado à água?
R: Se o etóxido de sódio fosse adicionado à água, ele reagiria vigorosamente, liberando gás hidrogênio e formando hidróxido de sódio.
