O éter dietílico ou etoxietano é um líquido incolor, altamente inflamável e volátil, comumente usado como solvente e como material de partida para a síntese de outros compostos orgânicos.
| Nome IUPAC | Etoxietano |
| Fórmula molecular | C4H10O |
| Número CAS | 60-29-7 |
| Sinônimos | Éter, éter etílico, óxido etílico, óxido dietílico, 1,1′-oxibisetano, éter, éter anestésico, éter sulfúrico, éter etílico |
| InChI | InChI=1S/C4H10O/c1-3-5-4-2/h3-4H2.1-2H3 |
Propriedades do éter dietílico
Densidade de éter dietílico g/ml
A densidade do éter dietílico é 0,713 g/mL. A densidade é definida como a massa de uma substância por unidade de volume. No caso do éter dietílico, sua densidade é inferior à da água, que tem densidade de 1 g/mL. Isso significa que o éter dietílico flutua na superfície da água.
Massa molar de éter dietílico
O éter dietílico tem massa molar de 74,12 g/mol. Massa molar é a massa de um mol de uma substância, expressa em gramas. No caso do etoxietano, um mol do composto contém 74,12 gramas. Este valor é derivado das massas atômicas de carbono, hidrogênio e oxigênio que compõem a molécula. A massa molar de uma substância é um parâmetro importante em cálculos químicos porque é usada para determinar a quantidade de substância presente em uma determinada amostra.
Estrutura do éter dietílico
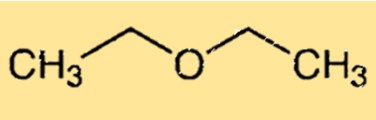
O éter dietílico tem uma estrutura química simples que consiste em dois grupos etil ligados a um átomo de oxigênio. A molécula tem uma forma curvada devido ao par solitário de elétrons no átomo de oxigênio, que faz com que a molécula se distorça da geometria tetraédrica ideal. A estrutura curva do etoxietano é responsável pela sua capacidade de formar ligações de hidrogénio com outras moléculas, tornando-o um solvente útil.
Ponto de ebulição do éter dietílico
O ponto de ebulição do éter dietílico é 34,6°C (94,3°F). O ponto de ebulição é a temperatura na qual uma substância passa do estado líquido para o estado gasoso à pressão atmosférica. O éter dietílico tem um ponto de ebulição relativamente baixo, o que o torna um líquido volátil que evapora facilmente à temperatura ambiente. Esta propriedade o torna útil como solvente e como anestésico na medicina.
Ponto de fusão do éter dietílico
O ponto de fusão do etoxietano é -116,3°C (-177,3°F). O ponto de fusão é a temperatura na qual uma substância sólida passa para o estado líquido à pressão atmosférica. O etoxietano é um líquido incolor à temperatura ambiente e é raro vê-lo no estado sólido devido ao seu baixo ponto de fusão.
Peso molecular de éter dietílico
O etoxietano tem um peso molecular de 74,12 g/mol. O peso molecular é a soma dos pesos atômicos de todos os átomos de uma molécula. É um parâmetro importante em reações químicas e estequiometria porque determina a quantidade de reagente necessária para formar uma quantidade específica de produto.
Fórmula de éter dietílico
A fórmula química do etoxietano é C4H10O. É composto por quatro átomos de carbono, dez átomos de hidrogênio e um átomo de oxigênio. A fórmula representa o número exato de cada tipo de átomo em uma molécula e é usada para determinar o peso molecular da substância. A fórmula química de uma substância é essencial nas equações químicas, onde é utilizada para equilibrar reações e determinar a quantidade de reagentes e produtos.
| Aparência | Líquido incolor |
| Gravidade Específica | 0,713 |
| Cor | Incolor |
| Cheiro | Suave, como éter |
| Massa molar | 74,12 g/mol |
| Densidade | 0,713g/ml |
| Ponto de fusão | -116,3°C (-177,3°F) |
| Ponto de ebulição | 34,6°C (94,3°F) |
| Ponto flash | -45°C (-49°F) |
| Solubilidade em Água | 6,9 g/L a 25°C |
| Solubilidade | Miscível na maioria dos solventes orgânicos |
| Pressão de vapor | 440 mmHg a 25°C |
| Densidade do vapor | 2,5 |
| pKa | 15,9 |
| pH | 7 (neutro) |
Éter dietílico Segurança e perigos
O etoxietano tem várias considerações de segurança e perigo que devem ser levadas em consideração ao manuseá-lo. É altamente inflamável e pode formar misturas explosivas de vapor e ar. Portanto, deve ser mantido longe de fontes de ignição e faíscas. Também pode causar irritação na pele, olhos e sistema respiratório, e a exposição prolongada pode causar tonturas e dores de cabeça. Ventilação adequada é necessária ao usar etoxietano, e equipamentos de proteção, como luvas e óculos de proteção, devem ser usados. Deve também ser armazenado em local fresco e seco, longe de agentes oxidantes e materiais incompatíveis.
| Símbolos de perigo | F, Xi |
| Descrição de segurança | S9, S16, S29, S33, S60, S61 |
| Números de identificação da ONU | ONU 1155 |
| Código SH | 2909.19.00 |
| Classe de perigo | 3 |
| Grupo de embalagem | II |
| Toxicidade | LD50 (oral, rato): 3.500 mg/kg |
Métodos para a síntese de éter dietílico
Existem vários métodos para sintetizar éter dietílico, incluindo a reação do etanol com ácido sulfúrico e a desidratação do etanol usando um agente desidratante, como ácido sulfúrico ou alumina.
Para sintetizar o etoxietano pelo método de desidratação, aqueça o etanol com um agente desidratante como ácido sulfúrico ou alumina para remover uma molécula de água, formando o etoxietano. Para melhorar o rendimento da reacção, pode ser utilizado um catalisador tal como hidróxido de potássio ou hidróxido de sódio.
Outro método de síntese de etoxietano é sintetizar o éter de Williamson, onde o etanol reage com um íon alcóxido, como o etóxido de sódio, para formar etoxietano. Esta reação requer o uso de uma base forte e um solvente adequado, como o etanol anidro.
Outro método para produzir etoxietano é usar a reação de Tishchenko. Neste processo, o ácido acético e o etanol reagem na presença de um catalisador como o ácido sulfúrico ou o óxido de alumínio, resultando em um alto rendimento de etoxietano.
Para produzir etoxietano como produto final, pode-se usar borohidreto de sódio ou amálgama de sódio para reduzir o acetaldeído. Este é outro método para sintetizar etoxietano. Esta reação resulta na formação de etanol , que pode então sofrer o método de desidratação descrito acima para formar etoxietano.
Usos do éter dietílico
Alguns usos do éter dietílico incluem:
- Solvente: Um solvente muito eficaz para uma variedade de compostos orgânicos, incluindo óleos, gorduras, resinas e ceras. Utilizado na produção de lacas, vernizes e outros revestimentos.
- Anestésico: Usado como anestésico para procedimentos cirúrgicos, embora tenha sido amplamente substituído por alternativas mais seguras na medicina moderna.
- Extração: Utilizado como solvente de extração na produção de produtos farmacêuticos, produtos naturais e óleos essenciais.
- Aditivo de combustível: Utilizado como aditivo de combustível para melhorar o desempenho de motores diesel, pois pode aumentar o índice de cetano do combustível.
- Intermediário químico: Um intermediário chave na produção de uma variedade de compostos orgânicos, incluindo etanol, acetaldeído e ácido acético.
- Aromatizante: utilizado como aromatizante na produção de determinados alimentos e bebidas, como doces e licores.
- Reagente de laboratório: Utilizado como reagente em experimentos de laboratório, principalmente em química orgânica.
- Propelente de aerossol: Usado como propelente em produtos de aerossol. As preocupações com a segurança levaram ao abandono gradual deste uso.
Questões:
P: O éter dietílico é polar?
R: Sim, o etoxietano é uma molécula polar devido à presença do átomo de oxigênio, que cria uma carga parcial negativa em uma extremidade da molécula e uma carga parcial positiva na outra extremidade.
P: O éter dietílico é miscível com água?
R: O etoxietano não é muito solúvel em água. No entanto, é considerado parcialmente miscível em água, o que significa que pode misturar-se com água até certo ponto, mas não completamente.
P: O éter dietílico é inflamável?
R: Sim, o etoxietano é altamente inflamável e pode formar misturas explosivas com o ar.
P: O éter dietílico é polar ou apolar?
R: O etoxietano é uma molécula polar devido à presença do átomo de oxigênio.
P: O éter dietílico é polar aprótico?
R: Sim, o etoxietano é considerado um solvente polar aprótico, o que significa que pode dissolver moléculas polares, mas não possui um átomo de hidrogênio que possa atuar como doador de ligações de hidrogênio.
