O etileno, também conhecido como etileno, é um gás incolor, inflamável e com odor adocicado. É uma parte essencial da indústria química, utilizada na produção de plásticos, solventes e outros produtos químicos.
| Nome da IUPAC | Eteno |
| Fórmula molecular | C2H4 |
| Número CAS | 74-85-1 |
| Sinônimos | Etileno, Eteno (erro), Gás oleificante, Elayl, 1,2-Dihidrogênio etileno |
| InChI | InChI=1S/C2H4/c1-2/h1-2H2 |
Fórmula de etileno
A fórmula química do eteno é C2H4. Representa o número e tipo de átomos presentes em uma molécula de eteno. A fórmula é utilizada em reações químicas e cálculos envolvendo etileno, como determinação da estequiometria de uma reação ou da quantidade de etileno necessária para um determinado processo industrial.
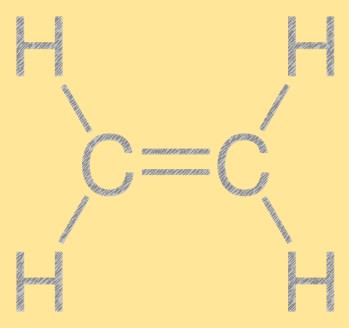
Estrutura do etileno
O etileno tem uma estrutura linear simples, com dois átomos de carbono ligados por uma ligação dupla e quatro átomos de hidrogênio ligados a cada átomo de carbono. A ligação dupla carbono-carbono é responsável pela reatividade do etileno, tornando-o um elemento útil na indústria química. A molécula tem uma estrutura plana, com todos os átomos situados no mesmo plano.
Massa molar de eteno
A massa molar do eteno, também chamado de etileno, é 28,05 g/mol. É uma molécula orgânica simples composta por dois átomos de carbono e quatro átomos de hidrogênio, representada pela fórmula química C2H4. A massa molar é calculada adicionando as massas atômicas dos átomos individuais da molécula.
A massa molar é um parâmetro importante em reações químicas e cálculos envolvendo etileno. É utilizado para determinar a quantidade de etileno necessária em uma reação, bem como a quantidade de produtos que podem ser produzidos.
Ponto de ebulição do etileno
O ponto de ebulição do eteno é -103,7°C (-154,7°F). O etileno é um gás à temperatura e pressão ambientes e seu ponto de ebulição é muito inferior ao da água, facilitando sua separação de outras substâncias nos processos industriais.
O ponto de ebulição do eteno depende da pressão e da pureza da amostra. A pressões mais elevadas, o ponto de ebulição do eteno aumenta. Da mesma forma, impurezas presentes na amostra podem fazer com que o ponto de ebulição varie do valor esperado.
Ponto de fusão do eteno
O ponto de fusão do etileno é -169,2°C (-272,6°F). O etileno é uma molécula apolar com formato linear, o que a torna uma molécula relativamente simples em comparação com muitos outros compostos orgânicos. Isto se reflete em seu baixo ponto de fusão.
Assim como o ponto de ebulição, o ponto de fusão do etileno pode variar dependendo da pureza da amostra. As impurezas podem diminuir o ponto de fusão e dificultar a obtenção de uma amostra pura para fins experimentais.
Densidade de etileno g/ml
A densidade do etileno é 0,958 g/mL sob condições padrão de temperatura e pressão (STP), definidas como 0°C (32°F) e 1 atm de pressão. O etileno é menos denso que o ar, o que significa que pode subir e dispersar-se na atmosfera.
A densidade é uma propriedade física importante do etileno porque é utilizada em processos industriais para determinar a quantidade de etileno necessária para um determinado volume de espaço. Também é usado para calcular a massa de etileno em uma amostra.
Peso molecular do etileno
O peso molecular do etileno é 28,05 g/mol. É a soma dos pesos atômicos dos átomos que constituem a molécula. O peso molecular é um parâmetro importante em muitos cálculos químicos, particularmente na determinação da estequiometria de uma reação e da quantidade de reagentes e produtos necessários ou produzidos.
| Aparência | Gás incolor |
| Densidade específica | 0,968 g/mL a 20°C (68°F) |
| Cor | Incolor |
| Cheiro | Doce, picante |
| Massa molar | 28,05 g/mol |
| Densidade | 0,958 g/mL a 0°C e 1 atm |
| Ponto de fusão | -169,2°C (-272,6°F) |
| Ponto de ebulição | -103,7°C (-154,7°F) a 1 atm de pressão |
| Ponto flash | -136°C (-213°F) |
| Solubilidade em Água | 3,5 g/L a 25°C (77°F) |
| Solubilidade | Insolúvel em água, solúvel em solventes orgânicos |
| Pressão de vapor | 114,6 kPa a 20°C (68°F) |
| Densidade do vapor | 0,97 (ar = 1) |
| pKa | 44 |
| pH | Não aplicável, uma vez que o etileno não é uma solução aquosa |
Segurança e perigos do etileno
O etileno é um gás altamente inflamável que pode formar misturas explosivas com o ar. Pode inflamar-se espontaneamente no ar se a concentração for suficientemente elevada. O etileno também é asfixiante e pode deslocar o oxigênio em espaços confinados, representando um perigo chocante.
O contato com etileno líquido ou a exposição a altas concentrações de gás pode causar queimaduras ou queimaduras. O etileno não é tóxico, mas os seus produtos de combustão, incluindo o monóxido de carbono e o dióxido de carbono, podem ser perigosos para a saúde humana.
O manuseio do etileno requer medidas de segurança adequadas, incluindo ventilação adequada, equipamento de proteção individual e precauções de segurança contra incêndio. O etileno deve ser armazenado e transportado em áreas bem ventiladas, longe de fontes de ignição.
| Símbolos de perigo | Gás inflamável (GHS02), asfixiante simples (GHS09) |
| Descrição de segurança | Manter afastado de fontes de ignição – Não fumar. Use apenas ferramentas que não produzam faíscas. Não respire gases. Use apenas ao ar livre ou em uma área bem ventilada. Use luvas de proteção/roupas de proteção/proteção ocular/proteção facial. |
| Números de identificação da ONU | ONU 1962 (gás comprimido) |
| Código SH | 2901.21.00 |
| Classe de perigo | 2.1 (gás inflamável) |
| Grupo de embalagem | N / D |
| Toxicidade | Não tóxico |
Métodos de síntese de etileno
Vários métodos podem ser usados para sintetizar etileno, incluindo craqueamento térmico de hidrocarbonetos e desidratação de álcoois.
No craqueamento térmico, o processo envolve o aquecimento de hidrocarbonetos como metano, propano e nafta a altas temperaturas (500 a 900 °C) na presença de um catalisador para quebrar moléculas de cadeia longa em moléculas menores, produzindo assim etileno. produtos.
Outro método comum é a desidratação de álcool, que envolve o uso de um catalisador como alumina ou sílica em altas temperaturas (250-350°C) para desidratar etanol ou outros álcoois e formar etileno e água.
O craqueamento a vapor é outro processo utilizado para produzir etileno, no qual vapor é adicionado aos hidrocarbonetos em altas temperaturas (700-900°C) para gerar uma mistura de etileno e outros produtos.
A decomposição térmica de materiais orgânicos como madeira, papel e plásticos também pode gerar etileno.
Outros métodos de síntese de etileno incluem a desidrogenação oxidativa do etano e o processo de conversão de metanol em olefinas.
Usos do etileno
O etileno é um importante produto químico industrial com uma ampla gama de utilizações.
- O etileno desempenha um papel crucial na produção de polietileno, um dos plásticos mais utilizados no mundo. As pessoas usam polietileno em diversas aplicações, como embalagens, tubos e materiais de construção.
- Os fabricantes utilizam o etileno como ingrediente chave na produção de outros polímeros, como o cloreto de polivinila (PVC). O PVC é útil em materiais de construção, dispositivos médicos e cabos elétricos.
- O etileno também é fundamental na fabricação de óxido de etileno, matéria-prima essencial na fabricação de detergentes, solventes e plásticos.
- Os fabricantes usam etileno para produzir etilenoglicol, um refrigerante e anticongelante para motores. É também matéria-prima na fabricação de fibras, filmes e resinas de poliéster.
- O etileno é usado como combustível para soldagem e corte de metais. Também atua como agente de amadurecimento de frutas e vegetais.
- O etileno é útil na síntese de vários compostos orgânicos, incluindo etanol e acetaldeído.
No geral, a versatilidade do etileno torna-o um componente essencial numa ampla gama de processos industriais, contribuindo para muitos aspectos da vida moderna.
Questões:
Quais dienos reagirão com o etileno em uma reação de Diels-Alder?
Qualquer dieno contendo duas ligações duplas conjugadas pode sofrer uma reação de Diels-Alder com eteno. Exemplos de tais dienos incluem 1,3-butadieno e isopreno.
Como os átomos de hidrogênio estão organizados no eteno?
No eteno, os dois átomos de carbono estão ligados entre si por uma ligação dupla. Cada átomo de carbono também está ligado a dois átomos de hidrogênio, com as valências restantes ocupadas por dois pares de elétrons não compartilhados em cada átomo de carbono. O arranjo dos átomos em torno de cada carbono é trigonal.
Quantas ligações pi se formam quando ocorre a hibridização sp2 no eteno, C2H4?
Quando ocorre a hibridização sp2 no eteno, uma ligação pi é formada entre os dois átomos de carbono. Os orbitais híbridos sp2 participam na formação de ligações sigma entre átomos de carbono e átomos de hidrogênio, enquanto os orbitais p de cada átomo de carbono se sobrepõem para formar a ligação pi. O etileno é classificado como um hidrocarboneto insaturado porque possui uma ligação dupla entre seus dois átomos de carbono. Esta ligação dupla consiste em uma ligação sigma e uma ligação pi, o que significa que o eteno tem menos átomos de hidrogênio do que um hidrocarboneto saturado comparável com o mesmo número de átomos de carbono.
