Etanol ou C2H6O é um álcool incolor e inflamável derivado de materiais vegetais, frequentemente usado como biocombustível ou solvente. Também é um ingrediente comum em bebidas alcoólicas.
| Nome IUPAC | Etanol |
| Fórmula molecular | C2H6O |
| Número CAS | 64-17-5 |
| Sinônimos | Álcool etílico, álcool de cereais, EtOH, álcool |
| InChI | InChI=1S/C2H6O/c1-2-3/h3H,2H2,1H3 |
Propriedades do etanol
Estrutura de Lewis C2H6O
A estrutura de Lewis para C2H6O (também conhecido como etanol) pode ser desenhada da seguinte forma:
AH
| |
HCOOH
| |
AH
Nesta estrutura, os dois átomos de carbono estão ligados entre si por uma única ligação covalente. Cada átomo de carbono também está ligado a três átomos de hidrogênio e um átomo de carbono está ligado a um átomo de oxigênio. O átomo de oxigênio está ligado ao átomo de carbono por uma única ligação covalente e possui dois pares de elétrons livres.
Esta estrutura satisfaz a regra do octeto, que afirma que cada átomo da molécula deve ter oito elétrons em sua camada de valência. Os átomos de carbono possuem quatro elétrons em sua camada de valência, enquanto os átomos de hidrogênio possuem um elétron cada. O átomo de oxigênio tem seis elétrons de valência e, com dois pares isolados adicionais, satisfaz a regra do octeto.
Massa molar de C2H6O
O etanol tem massa molar de aproximadamente 46,07 g/mol. A massa molar de uma substância é definida como a massa de um mol dessa substância. No caso do etanol, um mol de etanol contém aproximadamente 46,07 gramas da substância. A massa molar é um parâmetro útil em cálculos químicos porque permite a conversão entre a massa e os moles de uma substância.
Ponto de ebulição do etanol
O etanol tem um ponto de ebulição de aproximadamente 78,5°C (173,3°F) à pressão padrão. Este ponto de ebulição relativamente baixo facilita a evaporação do etanol, que é útil em muitos processos industriais. Por exemplo, o etanol é comumente usado como solvente na produção de produtos farmacêuticos, perfumes e outros produtos químicos.
Ponto de fusão do etanol
O etanol tem um ponto de fusão de aproximadamente -114,1°C (-173,4°F). Este baixo ponto de fusão torna o etanol um líquido à temperatura ambiente, razão pela qual é comumente usado na forma líquida como solvente ou combustível. O ponto de fusão do etanol é inferior ao da água, permitindo que o etanol seja utilizado como anticongelante em sistemas de refrigeração de automóveis.
Densidade do etanol g/mL
A densidade do etanol é de aproximadamente 0,789 g/mL em temperatura e pressão padrão. Isso significa que um mililitro de etanol pesa 0,789 gramas. A densidade do etanol é inferior à da água, que tem densidade de 1 g/mL em temperatura e pressão padrão. Isso significa que o etanol flutuará na superfície da água.
Peso molecular do etanol
O peso molecular do etanol é de aproximadamente 46,07 g/mol. O peso molecular é a soma dos pesos atômicos de todos os átomos de uma molécula. No caso do etanol, contém dois átomos de carbono, seis átomos de hidrogênio e um átomo de oxigênio. O peso molecular é usado para calcular o número de moles de uma substância em uma determinada massa da substância.
Estrutura do etanol
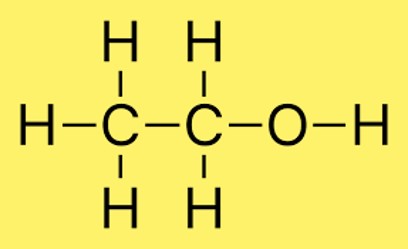
Na estrutura do etanol, dois átomos de carbono ligam-se através de uma ligação simples e três átomos de hidrogênio ligam-se a cada átomo de carbono. Além disso, um átomo de hidrogênio está ligado ao átomo de oxigênio. O arranjo dos átomos na molécula é comumente representado por CH3CH2OH.
Fórmula de etanol
A fórmula química do etanol é C2H6O. Esta fórmula mostra o número e tipo de átomos na molécula. A fórmula pode ser usada para calcular o peso molecular do etanol, bem como o número de moles de etanol em uma determinada massa da substância. A fórmula também é útil para prever o comportamento químico do etanol em reações com outros produtos químicos.
| Aparência | Líquido incolor |
| Gravidade Específica | 0,789 |
| Cor | Incolor |
| Cheiro | Odor característico |
| Massa molar | 46,07 g/mol |
| Densidade | 0,789g/ml |
| Ponto de fusão | -114,1°C (-173,4°F) |
| Ponto de ebulição | 78,5°C (173,3°F) à pressão padrão |
| Ponto flash | 13°C (55°F) |
| Solubilidade em Água | Miscível |
| Solubilidade | Solúvel em solventes polares e apolares |
| Pressão de vapor | 44,6kPa a 20°C |
| Densidade do vapor | 1,59 (ar = 1) |
| pKa | 15,9 a 25°C |
| pH | 7 (neutro) |
Segurança e perigos do etanol
O etanol é um líquido inflamável e pode representar risco de incêndio e explosão se não for manuseado adequadamente. Os vapores de etanol também podem inflamar-se facilmente e apresentar sério risco de incêndio. O etanol também pode ser prejudicial se ingerido, e o consumo excessivo pode levar à intoxicação por álcool. A inalação de grandes quantidades de vapor de etanol pode causar tonturas, dores de cabeça e náuseas. A exposição prolongada ao etanol também pode causar irritação e ressecamento da pele. O etanol deve ser armazenado em local fresco e bem ventilado, longe de fontes de ignição e substâncias incompatíveis. Equipamentos de proteção adequados, como luvas e óculos de segurança, devem ser usados ao manusear etanol.
| Símbolos de perigo | F, Xi, Flam. Líquido. 2 |
| Descrição de segurança | Manter afastado do calor, faíscas, chamas abertas e superfícies quentes. Proibido fumar. Use equipamentos elétricos, de ventilação e de iluminação à prova de explosão. Evite respirar vapores. Use luvas de proteção, óculos de proteção. Em caso de incêndio: Use pó químico seco, CO2, spray de água ou espuma para extinguir. Descarte o conteúdo/recipiente de acordo com os regulamentos locais/regionais/nacionais/internacionais. |
| Identificadores AN | ONU1170 |
| Código SH | 2207.10.00 |
| Classe de perigo | 3 |
| Grupo de embalagem | II |
| Toxicidade | O etanol pode ser tóxico se ingerido ou inalado em grandes quantidades. A exposição prolongada também pode causar irritação e ressecamento da pele. A ingestão crônica pode levar ao alcoolismo e outros problemas de saúde. |
Métodos de síntese de etanol
O etanol pode ser sintetizado por vários métodos, incluindo fermentação, hidratação direta de etileno e conversão de biomassa.
A fermentação é o método mais comum para a produção de etanol e envolve a conversão de açúcares e outros carboidratos em etanol por microrganismos como leveduras. Esse processo é utilizado para produzir etanol a partir de culturas como milho, cevada e cana-de-açúcar, bem como a partir de resíduos como restos de alimentos e resíduos agrícolas.
A hidratação direta do etileno é outro método de produção de etanol. Neste processo, o etileno reage com a água na presença de um catalisador como o ácido fosfórico para formar etanol. Este método é comumente usado em ambientes industriais e é mais eficiente que a fermentação.
A conversão de biomassa é outro método de produção de etanol e envolve a conversão de materiais vegetais, como lascas de madeira, gramíneas e resíduos agrícolas, em etanol. O processo envolve a quebra da celulose e da hemicelulose do material vegetal em açúcares simples que podem ser fermentados em etanol.
Outros métodos de produção de etanol incluem a conversão catalítica de dióxido de carbono e a redução eletroquímica de dióxido de carbono.
Cada um desses métodos tem suas vantagens e desvantagens, e a escolha do método depende de fatores como disponibilidade de matéria-prima, custo e eficácia. A fermentação continua sendo o método mais utilizado de produção de etanol devido à sua relação custo-benefício e confiabilidade.
Usos do etanol
O etanol tem uma ampla gama de usos industriais, comerciais e pessoais. Alguns de seus usos comuns incluem:
- O etanol aumenta os níveis de octanas e reduz as emissões quando usado como aditivo à gasolina.
- O etanol é um solvente versátil comumente utilizado na produção de produtos farmacêuticos, cosméticos e de cuidados pessoais.
- Bebidas alcoólicas como cerveja, vinho e destilados contêm etanol como ingrediente ativo.
- Desinfetantes para as mãos, produtos de limpeza de superfícies e outros produtos de limpeza usam etanol como desinfetante eficaz.
- O etanol é utilizado como solvente na extração de óleos essenciais, sabores e outros compostos naturais.
- Os produtores utilizam o etanol como matéria-prima para a produção de outros produtos químicos, como ácido acético e etileno.
- Produtos de higiene pessoal, como perfumes, loções e produtos para os cabelos, usam etanol como conservante e ingrediente de fragrância.
- Os laboratórios químicos geralmente usam etanol como solvente e reagente.
- Sistemas de refrigeração automotivos e outros podem usar etanol como agente anticongelante.
Questões:
Quantos átomos constituem uma molécula de etanol (C2H6O)?
Uma molécula de etanol (C2H6O) é composta por 9 átomos: 2 átomos de carbono, 6 átomos de hidrogênio e 1 átomo de oxigênio.
