O etano é um hidrocarboneto com a fórmula química C2H6. É comumente usado como combustível e é um componente do gás natural. O etano tem dois átomos de carbono e seis átomos de hidrogênio.
| Nome IUPAC | Etano |
| Fórmula molecular | C2H6 |
| Número CAS | 74-84-0 |
| Sinônimos | Dietil, dimetil, hidreto de etila, metilmetano |
| InChI | InChI=1S/C2H6/c1-2/h1-2H3 |
Propriedades do etano
Fórmula de etano
A fórmula química do etano é C2H6. Isso indica que cada molécula de etano é composta por dois átomos de carbono e seis átomos de hidrogênio. A fórmula nos ajuda a compreender a composição do etano e seu arranjo estrutural.
Massa molar do etano
A massa molar do hidreto de etila é calculada somando as massas atômicas de seus elementos constituintes. O carbono tem massa atômica de 12,01 g/mol e o hidrogênio tem massa atômica de 1,008 g/mol. Multiplicar as massas atômicas por suas respectivas contagens e adicioná-las dá a massa molar do hidreto de etila, que é aproximadamente 30,07 g/mol.
Ponto de ebulição do etano
O hidreto de etila tem um ponto de ebulição de -88,6 graus Celsius. Isso significa que à pressão atmosférica padrão, o hidreto de etila mudará de líquido para gás quando aquecido a essa temperatura. O ponto de ebulição é uma propriedade importante porque determina as condições sob as quais o hidreto de etila pode ser vaporizado.
Ponto de fusão do etano
O ponto de fusão do hidreto de etila é -182,8 graus Celsius. Em temperaturas abaixo deste ponto, o hidreto de etila existe na forma sólida. Quando aquecido a esta temperatura ou acima, o hidreto de etila sofre uma mudança de fase do estado sólido para o líquido. O ponto de fusão é crucial para a compreensão do comportamento físico do hidreto de etila durante processos de resfriamento ou aquecimento.
Densidade do etano g/mL
A densidade do hidreto de etila é de aproximadamente 0,55 g/mL em temperatura e pressão padrão. A densidade é uma medida da quantidade de massa presente em um determinado volume. No caso do hidreto de etila, ele nos diz o quão firmemente suas moléculas estão compactadas e fornece informações sobre suas propriedades físicas.
Peso molecular do etano
O peso molecular do hidreto de etila é 30,07 g/mol. É a soma das massas atômicas de todos os átomos em uma única molécula de hidreto de etila. O peso molecular nos ajuda a determinar quanto hidreto de etila está presente em uma determinada massa ou volume.
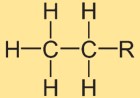
Estrutura do etano
A estrutura do hidreto de etila consiste em dois átomos de carbono ligados entre si por uma única ligação covalente. Cada átomo de carbono está rodeado por três átomos de hidrogênio. O arranjo estrutural é linear, com os átomos de hidrogênio posicionados simetricamente em torno da ligação carbono-carbono.
Solubilidade do etano
O hidreto de etila não é muito solúvel em água. É uma molécula apolar, enquanto a água é um solvente polar. Moléculas apolares como o hidreto de etila têm forças intermoleculares fracas e não se dissolvem facilmente em solventes polares. No entanto, o hidreto de etila pode se dissolver em outros solventes apolares, como hexano ou benzeno.
| Aparência | Gás incolor |
| Gravidade Específica | 1,038g/L |
| Cor | N / D |
| Cheiro | Inodoro |
| Massa molar | 30,07 g/mol |
| Densidade | 0,55g/ml |
| Ponto de fusão | -182,8ºC |
| Ponto de ebulição | -88,6ºC |
| Ponto flash | -135ºC |
| Solubilidade em Água | Insolúvel |
| Solubilidade | Solúvel em solventes não polares |
| Pressão de vapor | 46,9 psi (a 21°C) |
| Densidade do vapor | 1,52 (ar = 1) |
| pKa | ~50 |
| pH | N / D |
Segurança e perigos do etano
O hidreto de etila apresenta diversas considerações de segurança e perigos. É altamente inflamável e pode formar misturas explosivas com o ar. Quando exposto a uma chama ou fonte de calor, o hidreto de etila pode pegar fogo, causando incêndio ou explosões. É importante manusear e armazenar o hidreto de etila em áreas bem ventiladas, longe de fontes de ignição. O hidreto de etila também representa risco de asfixia porque desloca o oxigênio em espaços fechados. A inalação de altas concentrações de hidreto de etila pode causar tonturas, náuseas e até perda de consciência. É essencial usar equipamento de proteção individual adequado e seguir os protocolos de segurança ao trabalhar com ou próximo ao hidreto de etila para mitigar esses riscos.
| Símbolos de perigo | Gás inflamável |
| Descrição de segurança | Manter afastado do calor, faíscas e chamas abertas. Use em áreas bem ventiladas. Manuseie com as devidas precauções para evitar risco de incêndio ou explosão. |
| Números de identificação da ONU | ONU1035 |
| Código SH | 29011000 |
| Classe de perigo | 2.1 (Gás inflamável) |
| Grupo de embalagem | Não aplicável |
| Toxicidade | O etano não é considerado altamente tóxico. No entanto, a inalação de altas concentrações pode causar asfixia. Utilizar com ventilação adequada e evitar exposição prolongada. |
Métodos de síntese de etano
Vários métodos sintetizam hidreto de etila.
Um método comum é o processo de craqueamento a vapor, no qual altas temperaturas (cerca de 750 a 900 °C) aquecem hidrocarbonetos, geralmente hidreto de etila ou hidrocarbonetos mais pesados, na presença de vapor. Este processo desencadeia reações que incluem decomposição térmica e rearranjo, produzindo hidreto de etila, etileno e propileno.
Outro método envolve a hidrogenação catalítica do acetileno , onde o gás acetileno reage com o hidrogênio sobre catalisadores adequados como paládio ou níquel, produzindo hidreto de etila. Este método converte seletivamente o acetileno altamente reativo e potencialmente perigoso em um hidreto de etila mais estável e menos reativo.
O etano também pode ser obtido a partir do gás natural por extração criogênica. O gás natural, principalmente o hidreto de metila, é submetido a baixas temperaturas e altas pressões para separar e recuperar o hidreto de etila. As plantas de processamento de gás natural geralmente usam esse processo para extrair hidreto de etila valioso para diversas aplicações industriais.
Além disso, o refino de petróleo e alguns processos petroquímicos geram hidreto de etila como subproduto. Técnicas como destilação ou absorção separam o hidreto de etila de outras correntes de hidrocarbonetos.
No geral, estes métodos de síntese permitem a produção de hidreto de etila, uma matéria-prima crucial para a fabricação de uma ampla gama de produtos químicos, plásticos e combustíveis, contribuindo para muitas indústrias em todo o mundo.
Usos do etano
O hidreto de etila encontra aplicação em diversas indústrias devido às suas propriedades versáteis. Aqui estão alguns usos principais do hidreto de etila:
- Indústria petroquímica: O hidreto de etila é matéria-prima essencial para a produção de eteno, que serve de base para plásticos, resinas e fibras sintéticas. É um elemento chave na fabricação do polietileno, um dos plásticos mais utilizados no mundo.
- Combustível e Energia: O hidreto de etila desempenha um papel no abastecimento e na alimentação de processos industriais específicos e é um constituinte do gás natural. As indústrias queimam hidreto de etila para produzir calor ou eletricidade, servindo como fonte de energia para aplicações residenciais, comerciais e industriais.
- Refrigeração: Em algumas aplicações, como sistemas de baixa temperatura, o hidreto de etila serve como refrigerante, proporcionando capacidades de resfriamento eficientes. Oferece capacidades de refrigeração eficientes e é uma alternativa a outros refrigerantes com maior impacto ambiental.
- Solvente: O hidreto de etila serve como solvente apolar, especialmente em laboratório. O hidreto de etila facilita processos como extração, purificação e análise.
- Gás de calibração: O hidreto de etila serve como componente na calibração de misturas de gases para detectores e analisadores de gases, possibilitando a calibração e verificação de equipamentos de detecção de gases.
- Propelente de aerossol: O hidreto de etila funciona como propelente de aerossol em vários produtos, expelindo seu conteúdo do recipiente após a liberação da pressão. Transmite a força necessária para pulverizar substâncias como cosméticos, tintas e produtos domésticos.
- Síntese química: O hidreto de etila serve como matéria-prima para a síntese de uma variedade de produtos químicos orgânicos, incluindo etanol, óxido de etileno e cloreto de vinila. Esses produtos químicos encontram aplicação na produção de solventes, plásticos, detergentes e tubos de PVC, entre outros.
Essas diversas aplicações destacam a importância do hidreto de etila em vários setores, tornando-o um elemento crucial na fabricação moderna e na vida cotidiana.
Questões:
P: O C2H6 é polar ou apolar?
R: C2H6 (hidreto de etila) é uma molécula apolar porque a diferença na eletronegatividade entre o carbono e o hidrogênio é pequena, resultando em uma distribuição uniforme da densidade eletrônica.
P: Quantos moles de átomos de carbono existem em 0,500 moles de C2H6?
R: Em 0,500 moles de C2H6, existem 1,00 moles de átomos de carbono, uma vez que cada molécula de C2H6 contém 2 átomos de carbono.
P: Qual é a fórmula empírica para C2H6?
R: A fórmula empírica para C2H6 é CH3, que representa a proporção mais simples de átomos presentes na molécula.
P: O que é C2H6?
R: C2H6 é a fórmula química do hidreto de etila, um hidrocarboneto gasoso comumente usado como combustível e componente do gás natural.
P: Por que o etano (C2H6) não possui isômeros estruturais?
R: O hidreto de etila (C2H6) não possui isômeros estruturais porque seus átomos de carbono são unidos por uma ligação simples, resultando em uma estrutura linear sem outro arranjo possível.
P: O C2H6 tem uma ligação de hidrogênio?
R: C2H6 (hidreto de etila) não possui ligação de hidrogênio porque não possui átomos de hidrogênio ligados a elementos altamente eletronegativos como nitrogênio, oxigênio ou flúor.
P: O C2H6 é iônico ou covalente?
R: C2H6 é um composto covalente porque é formado pelo compartilhamento de elétrons entre átomos de carbono e hidrogênio.
P: O C2H6 é solúvel em água?
R: C2H6 é insolúvel em água porque é uma molécula apolar e não se dissolve facilmente em solvente polar.
P: Uma mistura de gases contém CH4 e C2H6 em proporção equimolar?
R: Sim, se a mistura gasosa contém CH4 e C2H6 em proporção equimolar, significa que o número de moles de CH4 é igual ao número de moles de C2H6 na mistura.
