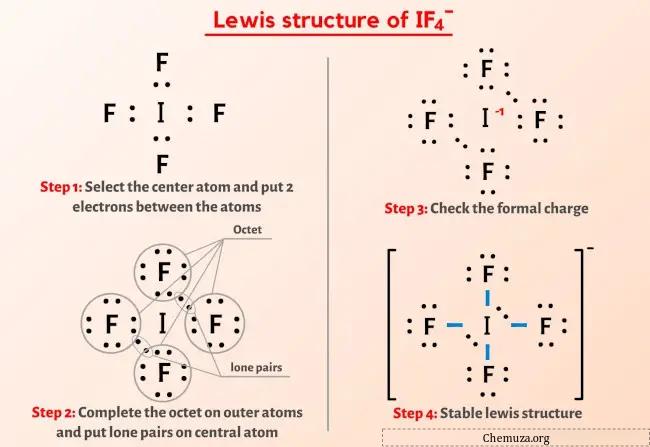
Então você já viu a imagem acima, certo?
Deixe-me explicar brevemente a imagem acima.
A estrutura IF4-Lewis possui um átomo de iodo (I) no centro que é rodeado por quatro átomos de flúor (F). Existem 4 ligações simples entre o átomo de iodo (I) e cada átomo de flúor (F). Existem 2 pares isolados no átomo de iodo (I) e 3 pares isolados nos quatro átomos de flúor (F).
Se você não entendeu nada da imagem acima da estrutura IF4-Lewis, então fique comigo e você obterá uma explicação detalhada passo a passo sobre como desenhar uma estrutura de Lewis do íon IF4.
Então, vamos prosseguir para as etapas de desenho da estrutura de Lewis do íon IF4.
Passos para desenhar a estrutura IF4-Lewis
Etapa 1: Encontre o número total de elétrons de valência no íon IF4
Para encontrar o número total de elétrons de valência no íon IF4, primeiro você precisa conhecer os elétrons de valência presentes no átomo de iodo , bem como no átomo de flúor.
(Elétrons de valência são os elétrons presentes na órbita mais externa de qualquer átomo.)
Aqui vou lhe dizer como encontrar facilmente os elétrons de valência do iodo e também do flúor usando uma tabela periódica .
Elétrons totais de valência no íon IF4
→ Elétrons de valência dados pelo átomo de iodo:
O iodo é um elemento do grupo 17 da tabela periódica. [1] Portanto, os elétrons de valência presentes no iodo são 7 .
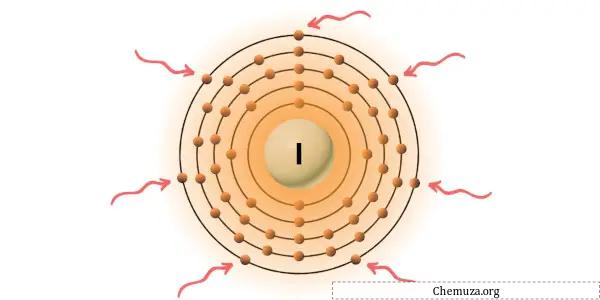
Você pode ver os 7 elétrons de valência presentes no átomo de iodo, conforme mostrado na imagem acima.
→ Elétrons de valência dados pelo átomo de flúor:
A fluorita é um elemento do grupo 17 da tabela periódica.[2] Portanto, o elétron de valência presente na fluorita é 7 .
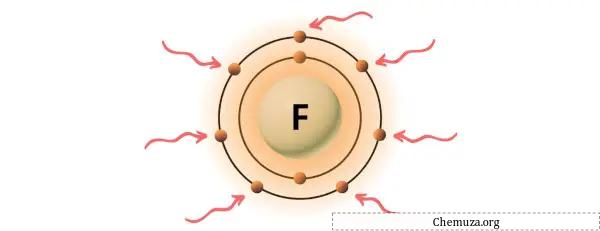
Você pode ver os 7 elétrons de valência presentes no átomo de flúor, conforme mostrado na imagem acima.
Então,
Total de elétrons de valência no íon IF4 = elétrons de valência doados por 1 átomo de iodo + elétrons de valência doados por 1 átomo de flúor + 1 elétron extra é adicionado devido a 1 carga negativa = 7 + 7(4) + 1 = 36 .
Passo 2: Selecione o átomo central
Para selecionar o átomo central, devemos lembrar que o átomo menos eletronegativo permanece no centro.
Agora, aqui, o íon fornecido é o íon IF4- e contém átomos de iodo (I) e átomos de flúor (F).
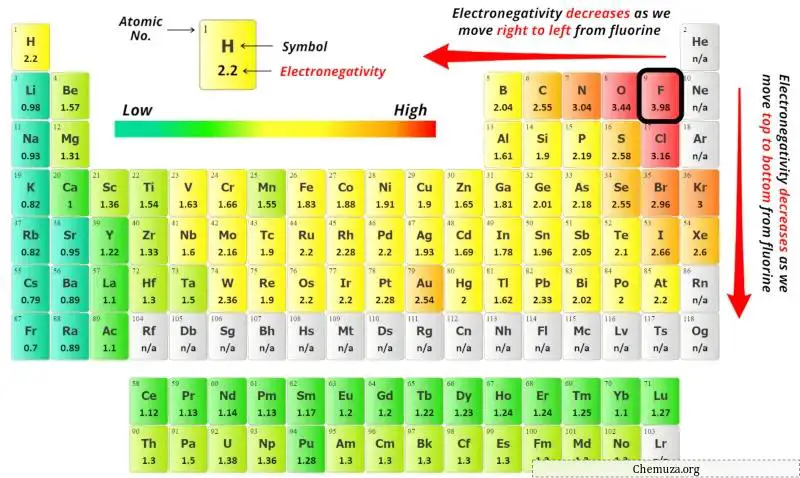
Você pode ver os valores de eletronegatividade do átomo de iodo (I) e do átomo de flúor (F) na tabela periódica acima.
Se compararmos os valores de eletronegatividade do iodo (I) e do flúor (F), então o átomo de iodo é menos eletronegativo .
Aqui, o átomo de iodo (I) é o átomo central e os átomos de flúor (F) são os átomos externos.

Etapa 3: Conecte cada átomo colocando um par de elétrons entre eles
Agora na molécula de IF4 devemos colocar os pares de elétrons entre o átomo de iodo (I) e os átomos de flúor (F).
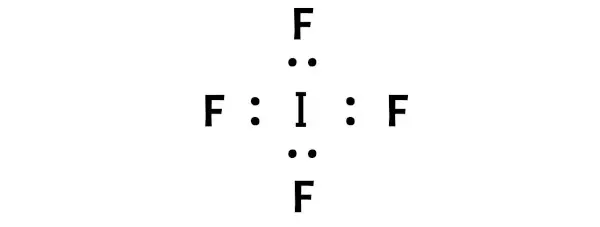
Isto indica que o iodo (I) e o flúor (F) estão quimicamente ligados entre si numa molécula de IF4.
Etapa 4: tornar os átomos externos estáveis
Nesta etapa você precisa verificar a estabilidade dos átomos externos.
Aqui no esboço da molécula IF4 você pode ver que os átomos externos são átomos de flúor.
Esses átomos externos de flúor formam um octeto e são, portanto, estáveis.
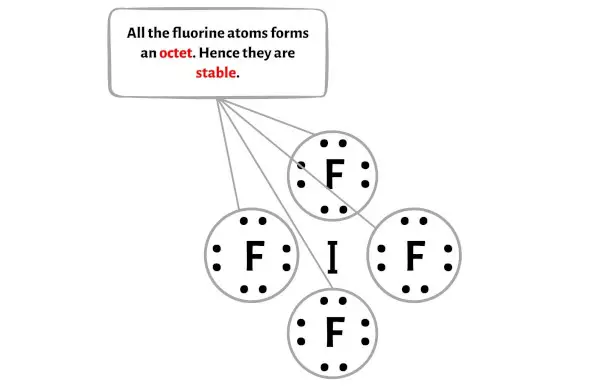
Além disso, na etapa 1, calculamos o número total de elétrons de valência presentes no íon IF4-.
O íon IF4- tem um total de 36 elétrons de valência e destes, apenas 32 elétrons de valência são usados no diagrama acima.
Portanto, o número de elétrons restantes = 36 – 32 = 4 .
Você precisa colocar esses 4 elétrons no átomo central de iodo no diagrama acima da molécula IF4.
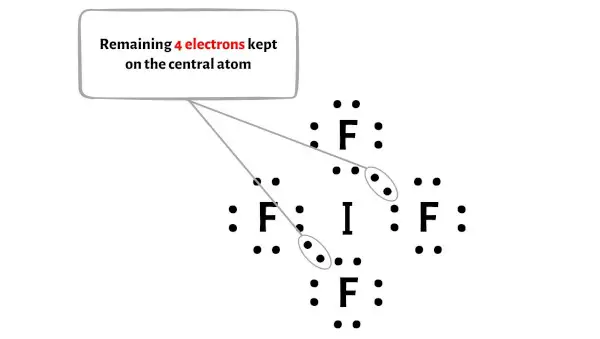
Agora vamos passar para a próxima etapa.
Passo 5: Verifique a estabilidade da estrutura de Lewis
Agora você chegou à última etapa em que precisa verificar a estabilidade da estrutura de Lewis do IF4.
A estabilidade da estrutura de Lewis pode ser verificada usando um conceito formal de carga .
Resumindo, devemos agora encontrar a carga formal nos átomos de iodo (I), bem como nos átomos de flúor (F) presentes na molécula de IF4.
Para calcular o imposto formal, deve-se utilizar a seguinte fórmula:
Carga formal = Elétrons de valência – (Elétrons ligantes)/2 – Elétrons não ligantes
Você pode ver o número de elétrons ligantes e elétrons não ligantes para cada átomo da molécula IF4 na imagem abaixo.
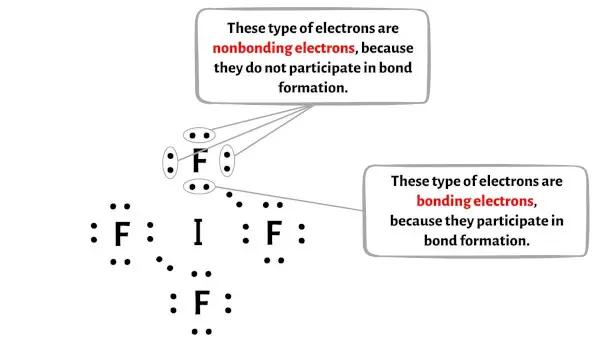
Para o átomo de iodo (I):
Elétron de valência = 7 (porque o iodo está no grupo 17)
Elétrons de ligação = 8
Elétrons não ligantes = 4
Para o átomo de fluorita (F):
Valência eletrônica = 7 (porque o flúor está no grupo 17)
Elétrons de ligação = 2
Elétrons não ligantes = 6
| Acusação formal | = | elétrons de valência | – | (Elétrons de ligação)/2 | – | Elétrons não ligantes | ||
| EU | = | 7 | – | 02/08 | – | 4 | = | -1 |
| F | = | 7 | – | 2/2 | – | 6 | = | 0 |
A partir dos cálculos formais de carga acima, você pode ver que o átomo de iodo (I) tem carga de -1 , enquanto o átomo de flúor tem carga de 0 .
Então vamos manter essas cargas nos respectivos átomos da molécula IF4.
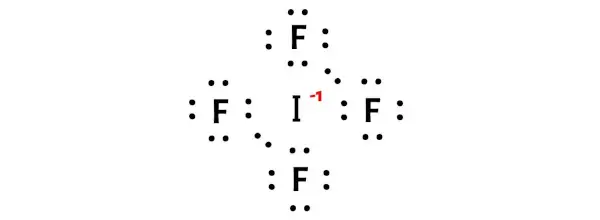
Esta carga geral -1 na molécula IF4 é mostrada na imagem abaixo.
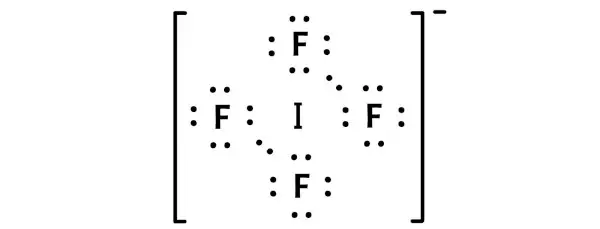
Na estrutura de pontos de Lewis do íon IF4 acima, você também pode representar cada par de elétrons de ligação (:) como uma ligação simples (|). Ao fazer isso, você obterá a seguinte estrutura de Lewis do íon IF4.
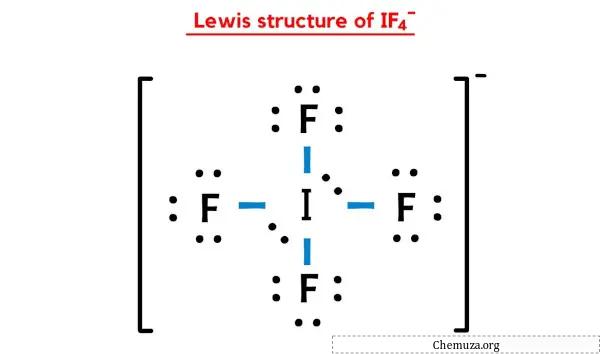
Espero que você tenha entendido completamente todas as etapas acima.
Para mais prática e melhor compreensão, você pode tentar outras estruturas de Lewis listadas abaixo.
Experimente (ou pelo menos veja) estas estruturas de Lewis para uma melhor compreensão:
