EDTA é um aminoácido policarboxílico que pode quelar íons metálicos. Tem a fórmula [CH2N(CH2CO2H)2]2. Ajuda a eliminar metais pesados do corpo. O EDTA também preserva amostras de sangue e produtos alimentícios.
| Nome Iupac | 2,2′,2″,2″‘-(etano-1,2-diildiamônia)tetraacetato dissódico |
| Fórmula molecular | C10H14N2Na2O8 |
| Número CAS | 139-33-3 |
| Sinônimos | Sal dissódico de ácido (etilenodinitrilo) tetraacético, edetato dissódico, EDTA dissódico, edetato dissódico, EDTA dissódico, sal dissódico de EDTA, sal dissódico de etilenobis (ácido iminodiacético), N,N’-1,2-etanodiilbis [N-(carboximetil )glicina], sal dissódico, Na2-EDTA, Na2H2EDTA |
| Inchi | InChI=1S/C10H16N2O8.2Na/c13-7(14)3-11(4-8(15)16)1-2-12(5-9(17)18)6-10(19)20;;/ h1-6H2,(H,13,14)(H,15,16)(H,17,18)(H,19,20);;/q;2*+1/p-2 |
Propriedades do EDTA
Fórmula EDTA
EDTA significa ácido etilenodiaminotetracético, que é um composto orgânico sintético capaz de quelar íons metálicos. A fórmula do EDTA é C10H16N2O8, o que significa que contém 10 átomos de carbono, 16 átomos de hidrogênio, 2 átomos de nitrogênio e 8 átomos de oxigênio em sua molécula.
Massa molar do EDTA
A massa molar do edetato dissódico é a soma das massas atômicas de todos os átomos de sua fórmula. As massas atômicas de carbono, hidrogênio, nitrogênio e oxigênio são 12,01 g/mol, 1,01 g/mol, 14,01 g/mol e 16,00 g/mol, respectivamente. . Portanto, a massa molar do edetato dissódico é (10 x 12,01) + (16 x 1,01) + (2 x 14,01) + (8 x 16,00) = 292,24 g/mol.
Ponto de ebulição do EDTA
O ponto de ebulição de uma substância é a temperatura na qual ela passa de líquido para gás. O ponto de ebulição do edetato dissódico não é fácil de medir porque ele se decompõe antes de atingir o ponto de ebulição. No entanto, algumas fontes estimam que o ponto de ebulição do edetato dissódico seja de aproximadamente 614,2 °C a uma pressão de 760 mmHg.
Ponto de fusão do EDTA
O ponto de fusão de uma substância é a temperatura na qual ela passa de sólida para líquida. O ponto de fusão do edetato dissódico depende do grau de hidratação e cristalização. A forma anidra do edetato dissódico tem um ponto de fusão de aproximadamente 240°C, enquanto a forma di-hidratada tem um ponto de fusão de aproximadamente 248°C.
Densidade de EDTA g/ml
A densidade de uma substância é a massa por unidade de volume. A densidade do edetato dissódico também varia dependendo do grau de hidratação e cristalização. A forma anidra de edetato dissódico tem uma densidade de aproximadamente 0,86 g/ml, enquanto a forma di-hidratada tem uma densidade de aproximadamente 1,6 g/ml.
Peso molecular do EDTA
O peso molecular de uma substância é outro termo para sua massa molar, que é a massa de um mol da substância. Como mencionado acima, a massa molar do edetato dissódico é 292,24 g/mol, portanto seu peso molecular também é 292,24 g/mol.
Estrutura do EDTA
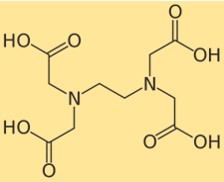
A estrutura do edetato dissódico mostra como seus átomos estão dispostos e ligados em sua molécula. O edetato dissódico possui um grupo etilenodiamina central com quatro grupos de ácido carboxílico ligados. Cada grupo ácido carboxílico pode perder um próton e formar uma carga negativa, que pode se ligar a um íon metálico. A estrutura do edetato dissódico pode ser representada pelo seguinte diagrama:
Solubilidade do EDTA
A solubilidade de uma substância é a quantidade que pode ser dissolvida em um determinado solvente a uma determinada temperatura e pressão. A solubilidade do edetato dissódico depende do pH e da presença de íons metálicos na solução. O edetato dissódico é mais solúvel em soluções alcalinas do que em soluções ácidas porque forma mais cargas negativas que podem interagir com as moléculas de água. O edetato dissódico também pode formar complexos com íons metálicos, o que pode aumentar ou diminuir sua solubilidade dependendo da estabilidade e carga do complexo. Por exemplo, a pH 7 e 25 °C, a solubilidade do edetato dissódico em água é de aproximadamente 0,5 M (186 mg/mL), enquanto a solubilidade do seu complexo de cálcio é de aproximadamente 0,02 M (7 mg/ml).
| Aparência | Sólido cristalino branco |
| Densidade específica | Não disponível |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 292,24 g/mol |
| Densidade | 1,6 g/ml (di-hidratado), 0,86 g/ml (anidro) |
| Ponto de fusão | 248°C (di-hidratado), 240°C (anidro) |
| Ponto de ebulição | 614,2°C (decompõe-se) |
| Ponto flash | 325,2°C |
| Solubilidade em Água | 0,5 M (186 mg/ml) a pH 7 e 25 °C |
| Solubilidade | Solúvel em soluções alcalinas, insolúvel em solventes orgânicos |
| Pressão de vapor | 3,77 x 10^-12 mmHg a 25°C |
| Densidade do vapor | Não disponível |
| pKa | 2,0, 2,7, 6,2, 10,3 |
| pH | 4 a 6 (solução 0,26 M) |
Riscos de segurança do EDTA
O edetato dissódico é um composto orgânico sintético que pode quelar íons metálicos. Suas aplicações são diversas nas áreas da medicina, indústria, agricultura e pesquisa. No entanto, também apresenta certos riscos para a saúde humana e para o ambiente se não for manuseado adequadamente.
O edetato dissódico pode irritar a pele e os olhos se entrar em contato com eles. Também pode causar náuseas, vômitos, diarréia e dor abdominal se ingerido. Pode prejudicar o sistema respiratório se inalado. Pode afetar as células sanguíneas e os rins se for absorvido pelo corpo. Pode ser fatal em grandes doses.
O edetato dissódico também pode contaminar o solo e a água se for liberado no meio ambiente. Pode ligar-se a metais essenciais e afetar a sua disponibilidade para plantas e animais. Pode interferir em processos biológicos que dependem de íons metálicos.
Use edetato dissódico com cautela e com equipamento de proteção adequado. Guarde-o em local fresco, seco e bem ventilado. Descarte-o de acordo com os regulamentos locais.
| Símbolos de perigo | |
| Descrição de segurança | S24/25: Evitar contato com pele e olhos |
| Números de identificação da ONU | UN3077 (sólido), UN3082 (líquido) |
| Código SH | 29224985 |
| Classe de perigo | 9 (vários materiais perigosos) |
| Grupo de embalagem | III (baixo perigo) |
| Toxicidade | Rato LD50 oral: 2.000 mg/kg |
Métodos de síntese de EDTA
Existem vários métodos para sintetizar o edetato dissódico, mas o mais comum é a condensação da etilenodiamina com ácido cloroacético ou seu sal sódico.
A reação envolve duas etapas: primeiro, o ataque nucleofílico da etilenodiamina ao ácido cloroacético ou ao seu sal de sódio forma um intermediário monoamida. Em segundo lugar, a remoção do ácido clorídrico ou do cloreto de sódio forma um grupo ácido carboxílico. Para formar edetato dissódico, ele pode reagir com outro equivalente de ácido cloroacético ou seu sal de sódio.
Outro método para sintetizar edetato dissódico é a oxidação da etilenodiamina com hipoclorito de sódio em solução alcalina. Este método produz edetato dissódico como sal de sódio e amônia como subproduto.
Outros métodos para sintetizar edetato dissódico incluem a reação de etilenodiamina com formaldeído e cianeto de sódio ou a reação de etilenodiamina com ácido glioxílico ou seus ésteres.
Usos do EDTA
O edetato dissódico é um composto orgânico sintético que pode quelar íons metálicos. Tem vários usos em diferentes campos e indústrias. Alguns dos usos do Edetato Dissódico são:
- Na medicina, o edetato dissódico pode tratar o envenenamento por metais pesados, ligando-se a metais tóxicos e removendo-os do corpo. Também pode prevenir coágulos sanguíneos e calcificação das artérias, quelando íons de cálcio.
- Em alimentos e bebidas, o edetato dissódico pode preservar a cor, o sabor e a textura dos produtos, evitando a oxidação e o ranço. Também pode prevenir a descoloração e deterioração causada por íons metálicos.
- Em cosméticos e cuidados pessoais, o edetato dissódico pode melhorar a estabilidade e a eficácia dos produtos, prevenindo o crescimento microbiano e reações catalisadas por metais. Também pode melhorar a aparência dos produtos ao quelar minerais responsáveis pela dureza da água.
- Na indústria e na pesquisa, o edetato dissódico pode melhorar o desempenho e a qualidade de produtos e processos ao quelar íons metálicos interferentes. Por exemplo, pode prevenir a formação de incrustações em caldeiras e tubulações, melhorar o tingimento e a impressão de têxteis, remover ferrugem e manchas de metais e controlar o pH e a concentração de metais em métodos analíticos.
Questões:
P: O que é EDTA?
R: O edetato dissódico é um composto orgânico sintético que pode quelar íons metálicos. Significa ácido etilenodiaminotetracético.
P: Como preparar uma solução de EDTA?
R: Para preparar uma solução de edetato dissódico, pese a quantidade desejada de edetato dissódico e dissolva em água destilada. Ajuste o pH para 8,0 com hidróxido de sódio.
P: Como dissolver o EDTA em água?
R: O edetato dissódico é solúvel em água, mas se dissolve lentamente. Para dissolver o edetato dissódico em água, aqueça a água a aproximadamente 80°C e mexa a mistura até que o edetato dissódico se dissolva completamente.
P: Como preparar EDTA 0,5M?
R: Para preparar edetato dissódico 0,5M, pese 73,06 g de edetato dissódico e dissolva em 800 ml de água destilada. Ajustar o pH para 8,0 com hidróxido de sódio e diluir a solução para 1 L com água destilada.
P: O que o EDTA faz?
R: O edetato dissódico liga-se a íons metálicos e forma complexos estáveis com eles. Isso evita que os íons metálicos reajam com outras substâncias ou interfiram nos métodos analíticos.
P: O que significa EDTA?
R: Edetato dissódico significa ácido etilenodiaminotetracético, que é o nome do composto com a fórmula [CH2N(CH2CO2H)2]2.
P: Como calcular a dureza da água por titulação com EDTA?
R: Para calcular a dureza da água por titulação de edetato dissódico, titule um volume conhecido de amostra de água com uma solução padrão de edetato dissódico usando um indicador apropriado. Registre o volume de edetato dissódico utilizado e use a seguinte fórmula: Dureza (mg/L como CaCO3) = (Volume de EDTA x Molaridade de EDTA x 1000) / Volume de amostra de água
