O dissulfeto de carbono é um composto químico volátil formado pela combinação de carbono e enxofre. É utilizado em processos industriais, solventes e fabricação de fibras de rayon.
| Nome IUPAC | Dissulfeto de carbono |
| Fórmula molecular | CS2 |
| Número CAS | 75-15-0 |
| Sinônimos | Dissulfeto de carbono, ditiocarbe, dissulfeto de carbono |
| InChI | InChI=1S/CS2/c2-1-3 |
Propriedades do dissulfeto de carbono
Fórmula de dissulfeto de carbono
A fórmula química do dissulfeto de carbono é CS2. Consiste em um átomo de carbono e dois átomos de enxofre, ligados entre si em um arranjo linear. Esta fórmula simples é essencial para compreender a composição básica do composto.
Massa molar de dissulfeto de carbono
A massa molar do dissulfeto de carbono é de aproximadamente 76,14 g/mol. Para calcular isso, somamos as massas atômicas de um átomo de carbono (12,01 g/mol) e dois átomos de enxofre (32,06 g/mol cada). Conhecer a massa molar ajuda em vários cálculos químicos.
Ponto de ebulição do dissulfeto de carbono
O dissulfeto de carbono tem um ponto de ebulição relativamente baixo, em torno de 46,3°C (115,3°F). Esta propriedade o torna volátil e facilmente vaporizável. Seu baixo ponto de ebulição é importante em processos industriais e aplicações que exigem evaporação rápida.
Ponto de fusão do dissulfeto de carbono
O ponto de fusão do dissulfeto de carbono é de aproximadamente -110,8°C (-187,4°F). Permanece no estado sólido em temperaturas abaixo deste ponto e muda para o estado líquido quando aquecido. Compreender seu ponto de fusão é crucial para manuseio e armazenamento.
Densidade de dissulfeto de carbono g/mL
A densidade do dissulfeto de carbono é de aproximadamente 1,26 g/mL à temperatura ambiente. Este valor significa sua massa por unidade de volume. Sendo mais denso que a água, afundará quando misturado e sua densidade afetará sua solubilidade em vários solventes.
Peso molecular do dissulfeto de carbono
O peso molecular do dissulfeto de carbono é de aproximadamente 76,14 g/mol, calculado a partir de sua fórmula química. Este valor desempenha um papel essencial na estequiometria e na determinação da quantidade de composto em reações químicas.
Estrutura do dissulfeto de carbono
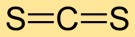
O dissulfeto de carbono tem uma estrutura molecular linear, com o átomo de carbono no centro e átomos de enxofre em cada lado. Este arranjo simples é crucial para a compreensão do seu comportamento químico e interações com outras substâncias.
Solubilidade do dissulfeto de carbono
O dissulfeto de carbono é pouco solúvel em água, com apenas cerca de 0,2 g por 100 ml de água à temperatura ambiente. No entanto, é muito solúvel em solventes orgânicos como benzeno e etanol. Este comportamento de solubilidade é essencial para diversas aplicações na química e na indústria.
| Aparência | Líquido incolor |
| Gravidade Específica | 1,26 |
| Cor | Incolor |
| Cheiro | Aroma pungente e doce |
| Massa molar | 76,14 g/mol |
| Densidade | 1,26g/ml |
| Ponto de fusão | -110,8°C (-187,4°F) |
| Ponto de ebulição | 46,3°C (115,3°F) |
| Ponto flash | -30°C (-22°F) |
| Solubilidade em Água | 0,2g/100ml (20°C) |
| Solubilidade | Solúvel em solventes orgânicos como benzeno e etanol |
| Pressão de vapor | 318mmHg (20°C) |
| Densidade do vapor | 2,62 (ar = 1) |
| pKa | ~ -2 |
| pH | Neutro (pH 7) |
Segurança e perigos do dissulfeto de carbono
O dissulfeto de carbono apresenta riscos significativos à segurança. É altamente inflamável e seus vapores podem formar misturas explosivas no ar. A exposição prolongada pode causar tonturas, dores de cabeça e até perda de consciência. Também é prejudicial à vida aquática e ao meio ambiente. Ventilação adequada, equipamento de proteção individual e armazenamento resistente ao fogo são essenciais para minimizar os riscos. Evite o contato com a pele e os olhos, pois pode causar irritação e danos. O manuseamento deve ocorrer em ambientes bem controlados e os derrames devem ser contidos rapidamente. Compreender e seguir as instruções de segurança é essencial para prevenir acidentes e garantir um ambiente de trabalho seguro ao manusear dissulfeto de carbono.
| Símbolos de perigo | Inflamável, prejudicial |
| Descrição de segurança | Líquido e vapor altamente inflamáveis. Nocivo se inalado ou engolido. Causa irritação na pele e nos olhos. |
| Números de identificação da ONU | ONU1131 |
| Código SH | 2813.10.1000 |
| Classe de perigo | 3 (Líquidos inflamáveis) |
| Grupo de embalagem | II (Perigo médio) |
| Toxicidade | Toxicidade moderada |
Métodos para a síntese de dissulfeto de carbono
Vários métodos ativos permitem a síntese de dissulfeto de carbono.
Um método comum envolve a reação do enxofre com metano ou gás natural em altas temperaturas, produzindo CS2 como produto.
Outra abordagem é reagir o vapor de enxofre com carvão quente. Além disso, a combinação de monóxido de carbono e vapor de enxofre sobre um catalisador também pode produzir dissulfeto de carbono.
Além disso, a síntese direta de CS2 pode ocorrer quando o carbono reage com o vapor de enxofre a temperaturas elevadas. No laboratório, os químicos utilizam a reação entre o xantato de potássio e o ácido sulfúrico para a produção em menor escala de dissulfeto de carbono.
Cada método requer precauções de segurança adequadas devido à natureza altamente inflamável e tóxica do dissulfeto de carbono. A versatilidade desses métodos de síntese permite diversas aplicações industriais, incluindo sua utilização como solvente, como matéria-prima em processos químicos e na fabricação de fibras de rayon.
Usos do dissulfeto de carbono
O dissulfeto de carbono encontra diversas aplicações devido às suas propriedades versáteis. Aqui estão alguns de seus usos:
- Aplicações em pesquisa e laboratório: Os laboratórios utilizam dissulfeto de carbono como reagente para diversas reações químicas, incluindo a síntese de compostos organometálicos.
- Extração de óleos essenciais: O dissulfeto de carbono tem aplicação na extração de óleos essenciais de plantas, facilitando a separação dos compostos aromáticos desejados.
- Extração de Óleo: As indústrias utilizam dissulfeto de carbono para extrair óleos de sementes e vegetais devido à sua solubilidade e baixo ponto de ebulição.
- Fabricação de fibra de rayon: O dissulfeto de carbono desempenha um papel vital na produção de fibras de rayon porque ajuda a dissolver a celulose, que os fabricantes extrusam para formar fibras sintéticas usadas em têxteis.
- Aplicações industriais: O dissulfeto de carbono contribui para a produção de pesticidas, fumigantes e produtos químicos para borracha. Além disso, atua como catalisador na fabricação de ácido sulfúrico e tetracloreto de carbono.
- Solvente: O dissulfeto de carbono serve como solvente para uma variedade de substâncias, incluindo óleos, graxas, borracha, resinas e enxofre. Por isso, é comumente utilizado na produção de produtos à base de celulose.
- Processos Químicos: Serve como matéria-prima na síntese de compostos orgânicos como tetracloreto de carbono, tiocarbamatos e ditiocarbamatos. Esses compostos encontram aplicações nas indústrias agrícola e farmacêutica.
- Vulcanização da borracha: O dissulfeto de carbono participa do processo de vulcanização da borracha, melhorando sua resistência, elasticidade e resistência ao desgaste.
Estas diversas aplicações destacam a importância do dissulfeto de carbono em diversas indústrias, desde têxteis e agricultura até pesquisa e manufatura.
Questões:
P: Qual das seguintes moléculas é polar? A. amônia B. octano c. água D. dissulfeto de carbono
R: a, A água (H2O) é polar devido à sua forma molecular curva e ao compartilhamento desigual de elétrons.
P: Qual é o ângulo entre as ligações carbono-enxofre na molécula de dissulfeto de carbono (CS2)?
R: O ângulo entre as ligações carbono-enxofre em CS2 é de 180 graus, formando uma geometria linear.
P: Quantos átomos no total existem em 1 mol de dissulfeto de carbono?
R: Um mol de dissulfeto de carbono contém 6,02 x 10 ^ 23 moléculas e cada molécula possui 3 átomos (1 carbono e 2 enxofre).
P: Qual desses elementos você acha que seria solúvel no solvente apolar, dissulfeto de carbono, CS2?
R: Substâncias não polares como octano (b) devem ser solúveis em dissulfeto de carbono (CS2).
P: Qual é o ponto de ebulição normal do dissulfeto de carbono?
R: O ponto de ebulição normal do dissulfeto de carbono é de aproximadamente 46,3°C (115,3°F).
P: O dissulfeto de carbono é polar ou apolar?
R: O dissulfeto de carbono (CS2) é uma molécula apolar devido à sua forma linear e compartilhamento igual de elétrons.
P: Qual é a fórmula do dissulfeto de carbono?
R: A fórmula do dissulfeto de carbono é CS2.
P: O que é dissulfeto de carbono?
R: O dissulfeto de carbono (CS2) é um composto químico volátil composto por um átomo de carbono e dois átomos de enxofre, usado em diversas aplicações industriais.
P: Quão importante é o fato de o dissulfeto de carbono ser mais denso que a água?
R: A maior densidade do dissulfeto de carbono em comparação com a água significa que ele não se misturará facilmente e formará camadas distintas quando combinado.
P: Como os humanos podem encontrar dissulfeto de carbono?
R: Os humanos podem entrar em contato com dissulfeto de carbono por meio de processos industriais, aplicações químicas ou manuseio de certos produtos.
P: O que acontece se você ingerir dissulfeto de carbono?
R: A ingestão de dissulfeto de carbono pode causar problemas de saúde, incluindo náuseas, dores de cabeça e efeitos no sistema nervoso, tornando-o perigoso para a saúde humana.
P: O dissulfeto de carbono é mais denso que a água?
R: Sim, o dissulfeto de carbono é mais denso que a água, com uma densidade de aproximadamente 1,26 g/mL em comparação com a densidade da água de 1 g/mL.
