O dióxido de cloro ou ClO2 é um agente branqueador muito eficaz e de ação rápida, utilizado no tratamento de água e na preservação de alimentos. É um gás verde amarelado com odor pungente.
| Nome IUPAC | Dióxido de cloro |
| Fórmula molecular | ClO2 |
| Número CAS | 10049-04-4 |
| Sinônimos | Peróxido de cloro, ClO2, óxido de cloro (IV) |
| InChI | InChI=1S/ClO2/c2-1-3 |
Fórmula de dióxido de cloro
A fórmula do dióxido de cloro é ClO2. É um gás altamente reativo composto por um átomo de cloro e dois átomos de oxigênio. A fórmula do dióxido de cloro reflete a sua estrutura molecular, que é crucial para a compreensão das suas propriedades físicas e químicas, incluindo a sua reatividade, estabilidade e solubilidade.
Massa molar de ClO2
ClO2 tem massa molar de 67,45 g/mol. É um agente oxidante muito reativo, conhecido por suas fortes propriedades clareadoras. O ClO2 é amplamente utilizado como desinfetante e sanitizante em diversas aplicações industriais e domésticas, incluindo tratamento de água, branqueamento de papel e preservação de alimentos. A massa molar de uma substância desempenha um papel crucial na determinação de suas propriedades físicas e químicas, incluindo densidade, ponto de ebulição e solubilidade.
Ponto de ebulição do ClO2
O ponto de ebulição do ClO2 é 11,3°C (52,3°F). O ClO2 existe como um gás verde amarelado à temperatura e pressão padrão. Possui odor pungente e é muito reativo, sendo um excelente agente oxidante. O ponto de ebulição de uma substância é uma propriedade física importante que ajuda a determinar sua estabilidade, volatilidade e transportabilidade.
Ponto de fusão do ClO2
O ponto de fusão do ClO2 é -51,5°C (-60,7°F). Por ser um gás em temperatura e pressão padrão, não possui estado sólido. O ClO2 é altamente solúvel em água e é comumente usado como desinfetante e sanitizante em aplicações de tratamento de água e preservação de alimentos. O ponto de fusão de uma substância é uma propriedade importante que pode afetar seu comportamento físico e químico, especialmente em reações que envolvem mudança de estado.
Densidade de ClO2 g/ml
A densidade do ClO2 é 1,97 g/mL em temperatura e pressão padrão. É um gás altamente reativo comumente usado como alvejante e desinfetante em diversas aplicações industriais. A densidade de uma substância é uma propriedade física importante que pode afetar seu comportamento em diversos processos, incluindo transporte, armazenamento e manuseio.
Peso molecular de ClO2
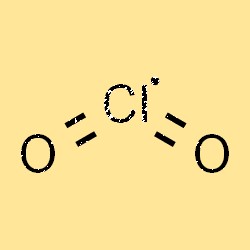
O peso molecular do ClO2 é 67,45 g/mol. É um agente oxidante amplamente utilizado em aplicações de tratamento de água, branqueamento de papel e preservação de alimentos. O peso molecular de uma substância é uma propriedade importante que afeta seu comportamento físico e químico, incluindo densidade, ponto de ebulição e solubilidade.
Estrutura do ClO2
A estrutura do ClO2 é representada pela fórmula molecular ClO2. É um gás altamente reativo composto por um átomo de cloro e dois átomos de oxigênio. A molécula tem uma forma curvada e é de natureza polar, o que significa que tem uma extremidade positiva e uma extremidade negativa. A estrutura do ClO2 desempenha um papel crucial na sua reatividade química, estabilidade e solubilidade em vários solventes.
| Aparência | Gás verde amarelado |
| Gravidade Específica | 1,97g/ml |
| Cor | verde amarelado |
| Cheiro | Acre |
| Massa molar | 67,45 g/mol |
| Densidade | 1,97g/ml |
| Ponto de fusão | -51,5°C (-60,7°F) |
| Ponto de ebulição | 11,3°C (52,3°F) |
| Ponto flash | Não aplicável (gás) |
| Solubilidade em Água | Muito solúvel |
| Solubilidade | Solúvel em água e solventes orgânicos |
| Pressão de vapor | Não especificado |
| Densidade do vapor | Não especificado |
| pKa | Não especificado |
| pH | Não especificado |
Nota Alguns dos valores listados são estimativas baseadas em dados disponíveis. É sempre melhor consultar uma fonte confiável para obter informações específicas e precisas sobre as propriedades de uma substância.
Segurança e perigos do dióxido de cloro
O ClO2 é uma substância altamente reativa e tóxica que pode representar riscos significativos para a saúde e a segurança se não for manuseada corretamente. A exposição a altas concentrações de gás ClO2 pode causar irritação nos olhos, nariz e garganta, bem como problemas respiratórios e dificuldade em respirar. A ingestão de ClO2 pode causar problemas digestivos graves, incluindo náuseas, vômitos e diarreia. O contato da pele com ClO2 pode causar irritação e queimaduras químicas. Além disso, o ClO2 é inflamável e pode inflamar-se na presença de calor ou faíscas. Para minimizar os riscos associados ao ClO2, é importante utilizar equipamentos de proteção individual adequados ao manuseá-lo, como luvas, óculos de proteção e respirador. Também é importante seguir práticas seguras de armazenamento e manuseamento para evitar a libertação de ClO2 no ambiente.
| Símbolos de perigo | Agente oxidante, tóxico |
| Descrição de segurança | S2- Manter fora do alcance das crianças. S22- Não respirar poeira. S26- Em caso de contato com os olhos, lavar imediatamente com água em abundância e consultar um médico. |
| Identificadores AN | ONU 1479 |
| Código SH | 2828.90.90 |
| Classe de perigo | 5.1 |
| Grupo de embalagem | III |
| Toxicidade | O dióxido de cloro é altamente tóxico quando inalado, ingerido ou em contato com a pele. Isso pode causar problemas respiratórios, problemas digestivos, irritação nos olhos e queimaduras químicas. |
Métodos de síntese de dióxido de cloro
O ClO2 é geralmente sintetizado por dois métodos principais: o processo clorato-clorito e o processo de eletrólise.
O processo clorato-clorito envolve a reação do clorato de sódio com um ácido, como o ácido sulfúrico, para produzir ClO2. Este processo pode ser realizado em escala industrial e é comumente utilizado para a produção de ClO2 para tratamento de água e outras aplicações.
O processo de eletrólise envolve o uso de uma corrente elétrica para gerar ClO2. Este processo é geralmente realizado em laboratório e é utilizado para a produção de pequenas quantidades de ClO2 para pesquisa e experimentação.
Independentemente do método de síntese utilizado, é importante seguir protocolos de segurança adequados e utilizar equipamento de proteção adequado ao manusear ClO2. Isso inclui o uso de luvas, proteção para os olhos e respirador para evitar a exposição ao gás altamente tóxico.
Além destes métodos, o dióxido de cloro também pode ser gerado pela reação do clorito de sódio com um ácido ou pela reação do clorato de sódio com ácido clorídrico. A escolha do método de síntese dependerá da aplicação específica e das propriedades desejadas do produto final.
Usos do dióxido de cloro
O dióxido de cloro é um produto químico versátil com uma ampla gama de aplicações, incluindo tratamento de água, preservação de alimentos e branqueamento. Alguns dos usos mais comuns do dióxido de cloro incluem
O dióxido de cloro para tratamento de água é comumente usado como desinfetante no tratamento de água potável, águas residuais e águas de processos industriais. É altamente eficaz contra uma ampla gama de patógenos, incluindo bactérias, vírus e parasitas, e é frequentemente usado como alternativa ao cloro ou ao ozônio.
O dióxido de cloro para preservação de alimentos é utilizado como agente antimicrobiano na preservação de frutas, vegetais, carnes e outros produtos alimentícios. É eficaz contra uma variedade de microrganismos, incluindo bactérias, leveduras e bolores, e ajuda a prolongar a vida útil dos produtos alimentares.
O dióxido de cloro é usado para branquear polpa de madeira e outras fibras para produzir cores brilhantes e uniformes. Também é utilizado no branqueamento de têxteis, como algodão e lã, para remover impurezas e melhorar a brancura.
Outros usos O dióxido de cloro também é utilizado no tratamento de resíduos industriais e municipais, bem como na produção de outros produtos químicos, como cloratos, cloraminas e outros desinfetantes. Em todas as suas aplicações, o dióxido de cloro é muito eficaz e oferece muitas vantagens sobre outros tratamentos químicos. No entanto, é importante ter cautela ao manusear e utilizar o dióxido de cloro, pois é uma substância altamente reativa e tóxica que pode representar riscos significativos à saúde e à segurança se não for manuseada corretamente.
