A dimetilamina (DMA) é um composto químico com odor de peixe. É utilizado em diversos processos industriais, como produção de produtos químicos agrícolas, farmacêuticos e surfactantes.
| Nome da IUPAC | N-metilmetanamina |
| Fórmula molecular | C2H7N |
| Número CAS | 124-40-3 |
| Sinônimos | DMA, N-metilmetanamina, dimetilamônia, metilamina, N-metilmetanamina, N-metilmetanamina, cloridrato de N-metilmetanamina |
| InChI | InChI=1S/C2H7N/c1-3-2/h3H,1-2H3 |
Propriedades da dimetilamina
Fórmula de dimetilamina
A dimetilamina é um composto orgânico com a fórmula química C2H7N. É um derivado da amônia, no qual dois dos três átomos de hidrogênio foram substituídos por grupos metil. Sua fórmula representa a composição de uma molécula de dimetilamina, que contém dois átomos de carbono, sete átomos de hidrogênio e um átomo de nitrogênio.
Massa molar de dimetilamina
A massa molar do DMA é 45,09 g/mol. É uma molécula relativamente pequena, o que contribui para o seu baixo ponto de ebulição e alta pressão de vapor. A massa molar é a massa de um mol de DMA e é calculada somando as massas atômicas de todos os átomos da molécula.
Ponto de ebulição da dimetilamina
O ponto de ebulição do DMA é -6,3°C. Este baixo ponto de ebulição torna o DMA um líquido volátil e inflamável. Ferve a uma temperatura mais baixa que a da água, o que significa que pode evaporar facilmente quando exposto ao ar. O ponto de ebulição de uma substância é a temperatura na qual ela passa de líquido para gás.
Ponto de fusão da dimetilamina
O ponto de fusão do DMA é -92°C. É um líquido incolor à temperatura ambiente, mas pode congelar para formar um sólido cristalino branco abaixo do seu ponto de fusão. O ponto de fusão de uma substância é a temperatura na qual ela passa de sólido para líquido.
Densidade de dimetilamina g/mL
A densidade do DMA é 0,67 g/mL. É menos denso que a água, que tem densidade de 1 g/mL. Isto significa que o DMA flutuará na água. A densidade de uma substância é a massa por unidade de volume da substância.
Peso molecular da dimetilamina
O peso molecular do DMA é 45,09 g/mol. É a soma dos pesos atômicos de todos os átomos de uma molécula de DMA. O peso molecular é útil para determinar quanto de uma substância é necessária para produzir um determinado volume ou concentração de uma solução.
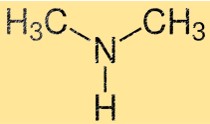
Estrutura da dimetilamina
A estrutura do DMA consiste em um átomo de nitrogênio ligado a dois grupos metil e um átomo de hidrogênio. É uma amina primária simples com formato piramidal. O átomo de nitrogênio possui um par de elétrons solitários, o que torna o DMA uma base fraca.
Solubilidade da dimetilamina
O DMA é solúvel em água, etanol e éter dietílico. Forma ligações de hidrogênio com moléculas de água, permitindo que se dissolva facilmente na água. Sua solubilidade em solventes orgânicos como etanol e éter dietílico se deve à sua capacidade de formar ligações de hidrogênio intermoleculares com as moléculas do solvente.
| Aparência | Líquido incolor |
| Gravidade Específica | 0,666 g/ml a 25°C |
| Cor | Incolor |
| Cheiro | Peixe, amônia |
| Massa molar | 45,09 g/mol |
| Densidade | 0,666 g/ml a 25°C |
| Ponto de fusão | -92ºC |
| Ponto de ebulição | -6,3ºC |
| Ponto flash | -32ºC |
| Solubilidade em Água | Solúvel em água |
| Solubilidade | Solúvel em etanol e éter dietílico |
| Pressão de vapor | 522 mmHg a 20°C |
| Densidade do vapor | 1,53 (ar = 1) |
| pKa | 10,73 |
| pH | 11.1 |
Segurança e perigos da dimetilamina
O DMA pode ser perigoso se não for manuseado corretamente. É altamente inflamável e pode inflamar-se facilmente na presença de calor, faíscas ou chamas. Também é tóxico e pode causar irritação nos olhos, pele e sistema respiratório. A exposição direta ao DMA pode causar dores de cabeça, tonturas e náuseas. É importante usar equipamentos de proteção como luvas, óculos de proteção e respiradores ao manusear o DMA. Deve ser armazenado em local fresco e seco, longe do calor e de fontes de ignição. Em caso de derramamento ou exposição, deverá ser manuseado de acordo com protocolos de segurança apropriados.
| Símbolos de perigo | F,T |
| Descrição de segurança | Altamente inflamável, tóxico, corrosivo |
| Números de identificação da ONU | ONU 1032 |
| Código SH | 2921.19.00 |
| Classe de perigo | 2.1 (Gás inflamável) |
| Grupo de embalagem | II |
| Toxicidade | LD50 (oral, rato) 230 mg/kg; LC50 (inalação, rato) 1660 ppm/4h |
Métodos de síntese de dimetilamina
Existem vários métodos para sintetizar DMA.
Um método comum envolve a reação de metanol e amônia na presença de um catalisador. Os químicos podem destilar e purificar o produto resultante para obter DMA puro.
Outro método envolve a reação de formaldeído e cloreto de amônio na presença de uma base, como hidróxido de sódio. A reação produz metilamina, que pode então reagir com formaldeído para dar DMA.
Para sintetizar o DMA, pode-se reagir com sulfato de dimetila e amônia . Esta reação é exotérmica e produz DMA e sulfato de amônio como subprodutos. No entanto, os químicos não costumam usar este método devido à natureza perigosa do sulfato de dimetila.
Para obter DMA, o cloreto de metila pode reagir com amônia . Esta reação também produz cloreto de amônio como subproduto.
No geral, a síntese do DMA requer um manuseio cuidadoso e o uso de equipamentos e equipamentos de proteção adequados devido à natureza perigosa das matérias-primas e às condições de reação.
Usos da dimetilamina
O DMA tem uma ampla gama de aplicações em diversas indústrias devido às suas propriedades químicas únicas. Aqui estão alguns dos usos comuns do DMA:
- Indústria agrícola: Vários herbicidas, inseticidas e fungicidas utilizam DEA como intermediário em sua produção.
- Produtos farmacêuticos: Utilizados como matéria-prima para a síntese de diversos produtos farmacêuticos, incluindo anestésicos locais, antibióticos e anti-histamínicos.
- Indústria da borracha: utilizado como acelerador de vulcanização na indústria da borracha, o que melhora as propriedades físicas dos produtos de borracha.
- Indústria Petrolífera: Usado como inibidor de corrosão e agente neutralizante no refino de petróleo.
- Tratamento de Água: Utilizado como floculante no tratamento de água para remover sólidos suspensos e outras impurezas.
- Solvente: Utilizado como solvente na produção de diversos produtos químicos, incluindo resinas, corantes e plásticos.
- Indústria têxtil: Utilizado como intermediário de tingimento e agente de acabamento na indústria têxtil.
- Cuidados Pessoais: Também utilizado como ingrediente em diversos produtos de cuidados pessoais, incluindo xampus e condicionadores, pois atua como ajustador de pH.
Questões:
P: Qual das alternativas a seguir representa a neutralização completa da dimetilamina?
R: A neutralização completa do DMA ocorre quando ele reage com ácido clorídrico para formar cloreto de dimetilamônio e água.
P: Que tipo de produto ocorre quando a 3-pentanona reage com a dimetilamina?
R: Quando a 3-pentanona reage com o DMA, o produto resultante é uma imina.
P: A dimetilamina é segura para o cabelo?
R: O DMA é comumente usado em produtos para os cabelos como ajustador de pH e é considerado seguro para uso em baixas concentrações.
P: A dimetilamina é boa para o cabelo?
R: O DMA pode beneficiar o cabelo quando usado em produtos capilares em concentrações apropriadas, pois pode ajudar a melhorar a eficácia de outros ingredientes.
P: O que é dimetilamina?
R: DMA é um composto orgânico com a fórmula química (CH3)2NH. É um gás incolor e de odor forte e comumente utilizado em diversos processos industriais.
P: É à base de dimetilamina?
R: O DMA é uma base fraca porque pode aceitar um próton de uma molécula de água para formar um íon hidróxido e um íon metilamônio.
P: Cetearil dimetilamina é uma garota cacheada?
R: Cetearyl DMA não é considerado aprovado para meninas cacheadas, pois é um ingrediente sintético comumente usado em produtos para os cabelos e pode não ser adequado para quem segue o método para meninas cacheadas.
P: Como encontro o pka da dimetilamina?
R: O pKa do DMA pode ser encontrado experimentalmente medindo o pH de uma solução de concentração conhecida de DMA e seu ácido conjugado e usando a equação de Henderson-Hasselbalch para calcular o valor do pKa.
P: Como você prepararia 100 ml de um tampão com pH 11,0 a partir de dimetilamina?
R: Para preparar um tampão com pH 11,0 a partir de DMA, seria necessário misturar uma certa quantidade de DMA com seu ácido conjugado, cloreto de dimetilamônio, em uma proporção específica para atingir o pH desejado. As quantidades exatas dependerão da capacidade tampão desejada e do pKa do ácido conjugado.
