Sulfeto de cobre (I) (Cu2S) é um composto sólido preto. É usado como semicondutor tipo P e catalisador em diversas aplicações industriais, como células solares e produção de hidrogênio.
| Nome IUPAC | Sulfeto de cobre(1+) |
| Fórmula molecular | Cu2S |
| Número CAS | 22205-45-4 |
| Sinônimos | Monossulfeto de cobre, sulfeto de cobre, sulfeto de cobre (1+), sulfeto de cobre, sulfeto cúprico, sulfeto cuproso |
| InChI | InChI=1S/2Cu.S/q2*+1;-2 |
Massa molar de sulfeto de cobre (I)
O sulfeto de cobre (I) tem massa molar de 159,16 g/mol. Massa molar é a massa de um mol de uma substância, calculada pela soma das massas atômicas dos elementos presentes no composto. O sulfeto de cobre (I) é composto por dois átomos de cobre e um átomo de enxofre, cada um com sua respectiva massa atômica. Conhecer a massa molar é importante em vários cálculos químicos, como determinar a quantidade de uma substância necessária para uma reação específica ou encontrar a fórmula empírica de um composto.
Ponto de ebulição do sulfeto de cobre (I)
O sulfeto de cobre (I) tem um ponto de fusão alto de 1103°C, mas não possui um ponto de ebulição distinto. Isso ocorre porque quando aquecido a altas temperaturas, o sulfeto de cobre (I) se decompõe em vez de ferver. A decomposição do sulfeto de cobre(I) leva à formação de gás cobre e sulfeto de cobre, que podem então ser coletados e analisados. A falta de ponto de ebulição para o sulfeto de cobre (I) não é incomum para muitos compostos sólidos que se decompõem com o aquecimento.
Ponto de fusão do sulfeto de cobre (I)
O sulfeto de cobre (I) tem um ponto de fusão de 1103°C. O alto ponto de fusão é devido à forte ligação iônica entre os átomos de cobre e enxofre na estrutura cristalina do composto. O alto ponto de fusão do sulfeto de cobre(I) o torna útil em aplicações de alta temperatura, como em células solares, onde atua como um semicondutor do tipo p.
Densidade de sulfeto de cobre (I) g/ml
O sulfeto de cobre (I) tem uma densidade de 5,6 g/mL. A densidade de uma substância é a massa de uma substância por unidade de volume. A alta densidade do sulfeto de cobre (I) se deve aos átomos pesados presentes no composto, bem como à sua estrutura cristalina. A alta densidade do sulfeto de cobre (I) o torna útil em uma variedade de aplicações, inclusive como pigmento em cerâmica e vidro.
Peso molecular de sulfeto de cobre (I)
O peso molecular do sulfeto de cobre (I) é 159,16 g/mol. O peso molecular é a soma dos pesos atômicos de todos os átomos de uma molécula. O sulfeto de cobre (I) tem uma fórmula química simples que consiste em dois átomos de cobre e um átomo de enxofre, portanto seu peso molecular é relativamente fácil de calcular. O peso molecular de um composto é importante em vários cálculos químicos, como determinar a estequiometria de uma reação ou encontrar a fórmula molecular de um composto.
Estrutura do sulfeto de cobre (I)
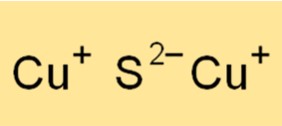
O sulfeto de cobre (I) tem uma estrutura cristalina cúbica de face centrada (fcc). A estrutura cristalina é composta por átomos de cobre e enxofre, com cada átomo de cobre rodeado por quatro átomos de enxofre dispostos em um arranjo tetraédrico. A forte ligação iônica entre os átomos de cobre e enxofre resulta em uma estrutura cristalina estável com alto ponto de fusão. A estrutura cristalina do sulfeto de cobre (I) é importante para a compreensão de suas propriedades físicas e químicas, bem como de suas diversas aplicações.
Fórmula de Sulfeto de Cobre (I)
A fórmula química do sulfeto de cobre (I) é Cu2S, o que indica que o composto é composto por dois átomos de cobre e um átomo de enxofre. A fórmula de um composto fornece informações sobre os elementos presentes e o número de átomos de cada elemento no composto. A fórmula do sulfeto de cobre (I) é útil em vários cálculos químicos, como determinar a proporção molar de cobre e enxofre no composto ou encontrar a fórmula empírica do composto.
| Aparência | Preto sólido |
| Gravidade Específica | 5,6 g/ml |
| Cor | Preto |
| Cheiro | Inodoro |
| Massa molar | 159,16 g/mol |
| Densidade | 5,6 g/ml |
| Ponto de fusão | 1103°C |
| Ponto de ebulição | Decompõe-se no aquecimento |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Insolúvel |
| Solubilidade | Insolúvel em água e solventes orgânicos |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Não aplicável |
Sulfeto de cobre (I) (Cu2S) Segurança e perigos
O sulfeto de cobre (I) (Cu2S) é geralmente considerado seguro para manuseio porque é um composto sólido estável e não reativo. No entanto, como todos os produtos químicos, deve ser manuseado com cuidado para evitar exposição acidental. Deve-se evitar a inalação de poeira ou vapores do composto, pois pode causar irritação ao sistema respiratório. O contato da pele com sulfeto de cobre (I) (Cu2S) também pode causar irritação ou reações alérgicas. É por isso que luvas e outras roupas de proteção devem ser usadas ao manuseá-lo. Em caso de ingestão acidental deve-se procurar atendimento médico imediatamente. Procedimentos adequados de manuseio, armazenamento e descarte devem ser seguidos para evitar riscos ambientais.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Evite inalação e contato com a pele. Use roupas de proteção. |
| Números de identificação da ONU | Não regulamentado |
| Código SH | 284290 |
| Classe de perigo | Não classificado como perigoso |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Baixa toxicidade |
Métodos para a síntese de sulfeto de cobre(I) (Cu2S)
Existem vários métodos para sintetizar sulfeto de cobre (I) (Cu2S), incluindo:
- Método de síntese direta: envolve a reação do pó de cobre com enxofre em alta temperatura em atmosfera inerte para formar sulfeto de cobre (I).
- Método solvotérmico: envolve o aquecimento de uma mistura de acetato de cobre e tioureia em um solvente a altas temperaturas e pressões para formar partículas de sulfeto de cobre (I).
- Método hidrotérmico: envolve a reação de sais de cobre e enxofre em uma solução aquosa a altas temperaturas e pressões para formar sulfeto de cobre (I).
- Método de deposição química de vapor: envolve a decomposição de um precursor contendo cobre em um ambiente de gás contendo enxofre para formar filmes de sulfeto de cobre (I).
- Método de pirólise por spray: envolve a pulverização de uma solução contendo sais de cobre e enxofre sobre um substrato aquecido para formar uma fina película de sulfeto de cobre (I).
- Método de co-precipitação: Envolve a precipitação simultânea de íons de cobre e enxofre em uma solução aquosa usando um agente precipitante adequado para formar sulfeto de cobre (I).
- Método eletroquímico: consiste na utilização de uma célula eletroquímica para depositar sulfeto de cobre (I) sobre um substrato a partir de uma solução contendo íons cobre e enxofre.
Esses métodos fornecem vários graus de controle sobre o tamanho, formato e propriedades das partículas ou filmes de sulfeto de cobre (I) resultantes, tornando-os úteis para diferentes aplicações.
Sulfeto de cobre (I) (Cu2S)
O sulfeto de cobre (I) (Cu2S) é um composto útil com diversas aplicações em diferentes campos. Aqui estão alguns de seus usos:
- Células fotovoltaicas: Utilizadas na fabricação de células fotovoltaicas. As células fotovoltaicas são usadas para produzir eletricidade.
- Pigmentos: Utilizados como pigmento na fabricação de diversos produtos, incluindo cerâmica, vidro e plásticos. Oferece uma cor preta profunda que resiste ao desbotamento e às intempéries.
- Lubrificantes: Utilizados como lubrificante em diversas aplicações devido ao seu baixo coeficiente de atrito. É particularmente útil em ambientes de alta temperatura e alta pressão.
- Semicondutores: Usados como material semicondutor em aplicações eletrônicas e optoeletrônicas. Possui propriedades ópticas e eletrônicas únicas que o tornam adequado para diversas aplicações, incluindo células fotovoltaicas, sensores e detectores.
- Fungicidas: Usado como fungicida na agricultura para proteger as plantações contra doenças fúngicas. É uma alternativa eficaz e ecológica aos fungicidas químicos tradicionais.
- Pigmentos Inorgânicos: Utilizados na fabricação de pigmentos inorgânicos. Esses pigmentos são utilizados na produção de vidros coloridos, cerâmicas e esmaltes. Sua cor preta profunda resiste ao desbotamento e às intempéries, tornando-o uma escolha popular para pigmentos de longa duração.
Questões:
P: O que é Cu2S?
R: Cu2S é a fórmula química do sulfeto de cobre (I), um composto de sulfeto de cobre comumente usado em várias aplicações, incluindo células fotovoltaicas, pigmentos, semicondutores e fungicidas.
P: O que resultará do aquecimento de uma mistura de Cu2O e Cu2S?
R: O aquecimento de uma mistura de Cu2O e Cu2S resultará em uma mistura de gás cobre e dióxido de enxofre, junto com qualquer Cu2O ou Cu2S que não reagiu.
P: Qual é o nome do composto Cu2S? R: O nome do composto Cu2S é sulfeto de cobre (I).
