O cloro (Cl2) é um gás amarelo-esverdeado muito reativo. É utilizado no tratamento de água, como desinfetante e na produção de diversos produtos químicos, como PVC e solventes.
| Nome IUPAC | Dicloro |
| Fórmula molecular | Cl2 |
| Número CAS | 7782-50-5 |
| Sinônimos | Cloro molecular, Cloro, Cloro, Cloro, Cloro, Cloreto de cloro |
| InChI | InChI=1S/Cl2/c1-2 |
Cl2 Massa molar
A massa molar de Cl2, ou cloro, é a soma das massas atômicas de dois átomos de cloro, ou 70,906 g/mol. É importante conhecer a massa molar do Cl2 ao calcular a quantidade de substância necessária para uma reação química ou ao converter entre diferentes unidades de medida.
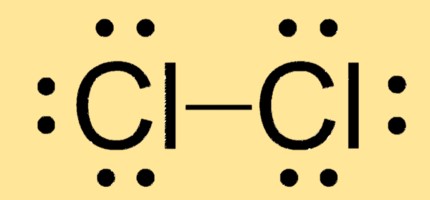
Estrutura de Lewis Cl2
Cl2 tem uma geometria molecular linear com dois átomos de cloro ligados por uma única ligação covalente. Sua estrutura de Lewis consiste em dois átomos de Cl, cada um com três pares isolados e um par de elétrons compartilhado entre eles.
Ponto de ebulição Cl2
O ponto de ebulição do Cl2 é -34,04°C (-29,27°F) à pressão padrão. Este é um ponto de ebulição relativamente baixo, que produz Cl2 gasoso à temperatura e pressão ambientes. É importante ter cuidado ao manusear o Cl2, pois ele pode facilmente se transformar em líquido ou sólido em baixas temperaturas e pressões.
Cl2 Ponto de fusão
O ponto de fusão do Cl2 é -101,5°C (-150,7°F) à pressão padrão. Este é um ponto de fusão relativamente baixo, que produz Cl2 gasoso à temperatura e pressão ambientes. É importante ter cuidado ao manusear o Cl2, pois ele pode facilmente se transformar em líquido ou sólido em baixas temperaturas e pressões.
Densidade Cl2 g/ml
A densidade do Cl2 é 0,003214 g/mL em temperatura e pressão padrão (STP). Isto significa que o Cl2 é muito menos denso que o ar e subirá para a atmosfera. O Cl2 pode ser armazenado em cilindros pressurizados ou em tanques contendo gases mais pesados que o ar, como o nitrogênio.
Peso molecular do cloro
O peso molecular do Cl2 é 70,906 g/mol. Esta é a massa de um mol de Cl2, que contém o número de moléculas de Avogadro (6,022 x 10 ^ 23). O peso molecular do Cl2 é importante para cálculos estequiométricos em química.
Estrutura do cloro
A estrutura do Cl2 é linear, com dois átomos de cloro ligados entre si por uma ligação covalente. O comprimento de ligação entre os dois átomos de cloro é 1,99 Ångstroms e a energia de ligação é 242 kJ/mol. A configuração eletrônica do Cl2 é [Ne]3s23p5, com cada átomo de cloro contribuindo com um elétron para o par de ligação.
Fórmula de cloro
A fórmula para Cl2 é simplesmente dois átomos de Cl ligados entre si. Isto é representado por Cl-Cl ou Cl2. A fórmula é importante para identificar a composição de um composto ou molécula e para cálculos estequiométricos em química.
| Aparência | Gás amarelo esverdeado |
| Gravidade Específica | 1,56 (líquido) |
| Cor | amarelo esverdeado |
| Cheiro | Odor pungente e sufocante |
| Massa molar | 70,906 g/mol |
| Densidade | 0,003214 g/mL em CNTP |
| Ponto de fusão | -101,5°C (-150,7°F) |
| Ponto de ebulição | -34,04°C (-29,27°F) |
| Ponto flash | Não inflamável |
| Solubilidade em Água | 0,92 g/100 mL a 20°C |
| Solubilidade | Solúvel em água, etanol, éter, benzeno e muitos solventes orgânicos |
| Pressão de vapor | 102,44kPa a 20°C |
| Densidade do vapor | 2,49 (ar = 1) |
| pKa | – |
| pH | – |
Cl2 Segurança e perigos
O cloro é um gás altamente reativo que pode representar sérios riscos à segurança e à saúde se não for manuseado adequadamente. Pode causar irritação respiratória grave e danos aos olhos, pele e membranas mucosas. A inalação de altas concentrações de cloro pode causar edema pulmonar, que pode ser fatal. O cloro também é muito corrosivo e pode danificar metais, plásticos e outros materiais. Para garantir o manuseio seguro do cloro, deve-se usar equipamento de proteção individual adequado, como óculos de proteção, luvas e respirador. O cloro só deve ser usado em áreas bem ventiladas e todos os recipientes devem ser devidamente rotulados e armazenados em local seguro.
| Símbolos de perigo | Caveira e ossos cruzados |
| Descrição de segurança | Gás altamente tóxico e corrosivo; causa irritação respiratória e cutânea grave; pode ser fatal se inalado em altas concentrações |
| Números de identificação da ONU | UN1017 |
| Código SH | 2801.1 |
| Classe de perigo | 2.3 |
| Grupo de embalagem | EU |
| Toxicidade | Muito tóxico; a inalação de altas concentrações pode causar edema pulmonar e ser fatal |
Métodos de síntese de cloro
Existem vários métodos para sintetizar cloro gasoso, incluindo eletrólise de salmoura, oxidação de HCl e decomposição térmica de cloretos metálicos.
O método mais comum é a eletrólise da salmoura, que envolve a passagem de uma corrente elétrica através de uma solução de cloreto de sódio (NaCl) e água (H2O). Este processo gera gás cloro no ânodo e gás hidrogênio no cátodo.
Outro método de produção de cloro é a oxidação do HCl com um agente oxidante, como KMnO4 ou MnO2. Esta reação produz cloro gasoso e água como subprodutos.
A decomposição térmica de cloretos metálicos, como MgCl2 ou FeCl3, é outro método de geração de gás cloro. Este processo envolve o aquecimento do cloreto metálico a uma alta temperatura, o que faz com que ele se decomponha e libere gás cloro.
No geral, o método de síntese utilizado para o cloro depende da aplicação específica e da pureza desejada do gás. Independentemente do método utilizado, é importante manusear o cloro com cautela devido à sua natureza altamente reativa e tóxica.
Usos do cloro
O gás cloro tem uma ampla gama de utilizações em diversas indústrias. Um dos principais usos do cloro é a produção de cloreto de polivinila (PVC), um material plástico amplamente utilizado. O cloro também é utilizado na produção de outros compostos de cloro, como clorofórmio e tetracloreto de carbono, que são utilizados como solventes e na fabricação de refrigerantes.
Na indústria de tratamento de água, o cloro é comumente usado como desinfetante para tratar água potável e águas residuais. O gás cloro é eficaz para matar bactérias e vírus e também pode oxidar e remover compostos orgânicos e outros contaminantes da água.
Na indústria de celulose e papel, o gás cloro é usado como agente de branqueamento para branquear produtos de papel. Também é utilizado na produção de têxteis, como náilon e poliéster, bem como na fabricação de corantes e pigmentos.
O gás cloro também tem outras aplicações, nomeadamente na produção de determinados produtos farmacêuticos e na indústria metalúrgica para decapagem e limpeza de superfícies metálicas. No entanto, devido à sua natureza perigosa, o cloro deve ser manuseado com cuidado e devem ser tomadas precauções de segurança adequadas durante o seu armazenamento, transporte e utilização.
Questões:
P: O Cl2 é polar ou apolar?
R: Cl2 é uma molécula apolar.
P: O cloro é um metal?
R: Não, o cloro não é um metal. É um halogênio e pertence ao grupo dos elementos não metálicos.
P: Que metal macio se combina com o cloro para formar o sal de cozinha?
R: O sódio (Na) é o metal macio que se combina com o cloro (Cl) para produzir sal de cozinha (NaCl).
P: Como clorar a água?
R: A cloração da água geralmente é feita adicionando uma quantidade medida de cloro gasoso, hipoclorito de sódio ou hipoclorito de cálcio ao abastecimento de água. A quantidade de cloro adicionada depende da qualidade da água e do nível de desinfecção desejado. O cloro reage com bactérias e outros microorganismos na água, matando-os efetivamente e tornando a água segura para beber.
P: Qual dos seguintes itens é tratado com cloro para obter pó descolorante?
R: O óxido de cálcio (CaO) é tratado com cloro (Cl2) para obter pó descolorante (CaOCl2).
