O cloreto de sódio (NaCl) é um composto formado por íons sódio e cloro. É comumente chamado de sal de cozinha e é usado para temperar alimentos e conservar produtos alimentícios.
| Nome IUPAC | Cloreto de Sódio |
| Fórmula molecular | NaCl |
| Número CAS | 7647-14-5 |
| Sinônimos | Halita, sal-gema, solução salina, sal marinho |
| InChI | InChI=1S/ClH.Na/h1H;/q;+1/p-1 |
Fórmula de cloreto de sódio
A fórmula química do cloreto de sódio é NaCl, representando a combinação de um íon sódio (Na+) e um íon cloreto (Cl-). A fórmula indica o número relativo de átomos ou íons do composto, permitindo fácil identificação e representação de sua composição.
Massa molar de NaCl
A massa molar do cloreto de sódio, também chamado de sal de cozinha, é 58,44 g/mol. Isto significa que um mol de cloreto de sódio contém 58,44 gramas do composto. A massa molar é calculada adicionando as massas atômicas de sódio (Na) e cloro (Cl) no composto, que são 22,99 g/mol e 35,45 g/mol, respectivamente.
Ponto de ebulição do cloreto de sódio
O cloreto de sódio tem um alto ponto de ebulição de 1.413 °C (2.575 °F) devido à sua ligação iônica. Quando aquecido, a entrada de energia quebra as ligações iônicas entre os íons sódio e cloreto, fazendo com que o composto mude de fase do estado sólido para o líquido. O ponto de ebulição do cloreto de sódio é superior ao de muitos outros compostos devido à forte atração eletrostática entre os íons.
Ponto de fusão do cloreto de sódio
O ponto de fusão do cloreto de sódio é 801°C (1474°F). Assim como o ponto de ebulição, o alto ponto de fusão é devido às fortes ligações iônicas entre os íons sódio e cloreto. Quando aquecido, a entrada de energia supera as forças eletrostáticas que mantêm os íons juntos, fazendo com que o composto faça a transição do estado sólido para o líquido.
Densidade de cloreto de sódio g/ml
A densidade do cloreto de sódio é 2,165 g/mL à temperatura ambiente (25°C ou 77°F). A densidade é uma medida da massa por unidade de volume de uma substância. A alta densidade do cloreto de sódio se deve ao arranjo compacto de seus átomos e à forte ligação iônica entre os íons sódio e cloreto.
Peso molecular do cloreto de sódio
O peso molecular do cloreto de sódio é 58,44 g/mol, conforme mencionado anteriormente. O peso molecular é calculado somando os pesos atômicos de todos os átomos de uma molécula. Embora o cloreto de sódio não exista como molécula no sentido tradicional, seu peso molecular é calculado com base na unidade de fórmula NaCl.
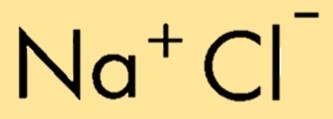
Estrutura do cloreto de sódio
O cloreto de sódio tem uma estrutura cristalina que consiste em um arranjo regular de íons sódio e cloreto na proporção de 1:1. A estrutura é uma rede cúbica de face centrada, com cada íon sódio rodeado por seis íons cloreto e cada íon cloreto rodeado por seis íons sódio. A ligação iônica no cloreto de sódio resulta em uma estrutura de rede muito estável e difícil de quebrar.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 2.165 |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 58,44 g/mol |
| Densidade | 2.165g/ml |
| Ponto de fusão | 801°C (1474°F) |
| Ponto de ebulição | 1.413°C (2.575°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 359 g/L a 20°C |
| Solubilidade | Solúvel em água e glicerol; insolúvel em etanol e acetona |
| Pressão de vapor | Insignificante |
| Densidade do vapor | Não aplicável |
| pKa | 7 |
| pH | 7 (neutro) |
Segurança e perigos do cloreto de sódio
O cloreto de sódio (NaCl) é geralmente considerado seguro para consumo e uso humano. Contudo, a exposição a altas concentrações de NaCl pode causar irritação nos olhos, pele e trato respiratório. A ingestão de grandes quantidades de NaCl pode causar desidratação, desequilíbrios eletrolíticos e até morte. O cloreto de sódio também pode representar risco de incêndio e explosão quando em contato com materiais combustíveis. O manuseio e armazenamento adequados são necessários para evitar acidentes. É importante seguir as orientações e precauções de segurança adequadas ao manusear e usar o NaCl para minimizar o risco de danos.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Nocivo por ingestão ou inalação. Causa irritação na pele e nos olhos. |
| Números de identificação da ONU | ONU 7646 |
| Código SH | 2501.00.90 |
| Classe de perigo | Não tóxico |
| Grupo de embalagem | Não aplicável |
| Toxicidade | LD50 (oral, rato) – 3.000 mg/kg |
Métodos para a síntese de cloreto de sódio
Várias fontes podem fornecer cloreto de sódio, incluindo minas de sal e água do mar, mas também é possível sintetizá-lo em laboratório através de reações químicas.
Um método comum para sintetizar cloreto de sódio envolve a reação de ácido clorídrico (HCl) e hidróxido de sódio (NaOH) . Esta reação produz cloreto de sódio e água como subprodutos. A equação para esta reação é:
HCl + NaOH → NaCl + H2O
Outro método envolve a reação de carbonato de sódio (Na2CO3) com ácido clorídrico (HCl) para produzir cloreto de sódio, dióxido de carbono e água. A equação para esta reação é:
2HCl + Na2CO3 → 2NaCl + CO2 + H2O
A reação entre sódio e cloro gasoso é um desses métodos de síntese de cloreto de sódio. Esta reação requer altas temperaturas e controle cuidadoso para evitar a formação de subprodutos indesejados. A equação para esta reação é:
2Na + Cl2 → 2NaCl
Os químicos podem optar por modificar ou variar os métodos de síntese de cloreto de sódio com base em fatores como custo, disponibilidade de reagentes e pureza e rendimento desejados do produto final. Esses métodos garantem a produção de cloreto de sódio mesmo que as fontes naturais sejam raras.
Usos do cloreto de sódio
O cloreto de sódio, também conhecido como sal de cozinha, tem muitos usos em diversas indústrias e aplicações. Alguns dos usos comuns do cloreto de sódio são:
- Indústria Alimentícia: Utilizado como tempero e intensificador de sabor em diversos produtos alimentícios, incluindo salgadinhos, carnes processadas e assados.
- Indústria Médica: Usado em soluções intravenosas e outros tratamentos médicos para repor os fluidos e eletrólitos do corpo.
- Indústria química: utilizada na produção de diversos produtos químicos, incluindo cloro, hidróxido de sódio e carbonato de sódio.
- Tratamento de Água: Utilizado no tratamento de água para remover impurezas e torná-la adequada para consumo.
- Agricultura: Utilizado como fertilizante para culturas, especialmente em áreas onde o solo é deficiente em nutrientes essenciais.
- Descongelamento: Usado como agente descongelante em estradas e calçadas no inverno para evitar acidentes devido a superfícies escorregadias.
- Indústria têxtil: Utilizada na produção de fibras sintéticas, como náilon e poliéster.
- Indústria de petróleo e gás: usada na perfuração e extração de petróleo e gás.
- Pecuária: Usado como suplemento dietético para gado para promover crescimento e desenvolvimento saudáveis.
Estes são apenas alguns exemplos dos muitos usos do cloreto de sódio. Sua versatilidade e disponibilidade o tornam um ingrediente essencial em muitos produtos e processos em uma ampla gama de indústrias.
Questões:
P: O cloreto de sódio é um composto?
R: Sim, o cloreto de sódio é um composto.
P: O cloreto de sódio é iônico ou covalente?
R: O cloreto de sódio é um composto iônico.
P: O que é cloreto de sódio?
R: O cloreto de sódio é um composto cristalino branco com a fórmula química NaCl. É comumente chamado de sal de cozinha e é essencial para a nutrição humana e animal.
P: Para que é usado o cloreto de sódio?
R: O cloreto de sódio tem muitos usos em diversas indústrias e aplicações, inclusive como tempero e intensificador de sabor em alimentos, como tratamento médico, na produção química, no tratamento de água, como agente de degelo, em têxteis e petróleo. e gás, e como suplemento alimentar para o gado.
P: O cloreto de sódio é solúvel em água?
R: Sim, o cloreto de sódio é altamente solúvel em água.
