Cloreto de potássio (KCl) é um composto que contém potássio e cloro. É usado como fertilizante, aditivo alimentar e tratamento médico para baixos níveis de potássio. Também pode ser usado em injeções letais.
| Nome IUPAC | Cloreto de Potássio |
| Fórmula molecular | KCl |
| Número CAS | 7447-40-7 |
| Sinônimos | KCl, Kalium Chloratum, Muriato de Potássio, Sylvite, Cloropotassuril, Kalitabs, Klotrix, Klor-Con, K-Dur |
| InChI | InChI=1S/ClH.K/h1H;/q;+1/p-1 |
Fórmula de Cloreto de Potássio
A fórmula química do cloreto de potássio é KCl. É um composto binário composto por um átomo de potássio e um átomo de cloro. A fórmula do cloreto de potássio é importante para a compreensão de suas propriedades químicas e para a realização de cálculos relacionados ao seu uso em diversas aplicações.
Massa molar de cloreto de potássio
A massa molar do KCl é 74,55 g/mol. É um sólido cristalino branco com sabor salgado e altamente solúvel em água. KCl é um composto formado por um átomo de potássio e um átomo de cloro.
Ponto de ebulição do cloreto de potássio
O ponto de ebulição do KCl é 1.420 °C (2.588 °F). É um composto de alto ponto de fusão que requer energia significativa para atingir seu ponto de ebulição. O alto ponto de ebulição do KCl o torna útil em aplicações de alta temperatura, como na produção de cerâmica e vidro.
Ponto de fusão do KCl
O ponto de fusão do KCl é 770°C (1.418°F). É um composto com ponto de fusão relativamente alto que requer calor significativo para derreter. O KCl é utilizado na produção de fertilizantes e seu alto ponto de fusão ajuda a garantir sua estabilidade em altas temperaturas.
Densidade de KCl g/ml
A densidade do KCl é 1,98 g/cm³. É um composto relativamente denso, o que significa que uma pequena quantidade contém um grande número de partículas. A alta densidade do KCl o torna útil em certas aplicações industriais, como na produção de fluidos de perfuração.
Peso molecular de KCl
O peso molecular do KCl é 74,55 g/mol. É um composto relativamente leve, o que significa que contém um pequeno número de partículas. O baixo peso molecular do KCl facilita o transporte e o manuseio em ambientes industriais.
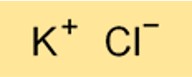
Estrutura KCl
A estrutura do KCl é uma rede cristalina iônica. Consiste em íons alternados de potássio e cloro dispostos em um padrão repetitivo. A natureza iônica da estrutura significa que o KCl é um bom condutor de eletricidade quando dissolvido em água.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 1,98g/cm³ |
| Cor | Incolor a branco |
| Cheiro | Inodoro |
| Massa molar | 74,55 g/mol |
| Densidade | 1,98g/cm³ |
| Ponto de fusão | 770°C (1.418°F) |
| Ponto de ebulição | 1420°C (2588°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 34,7g/100ml (0°C) |
| Solubilidade | Solúvel em água, glicerol e formamida; ligeiramente solúvel em etanol |
| Pressão de vapor | Insignificante |
| Densidade do vapor | Não aplicável |
| pKa | -1,8 (ácido conjugado) |
| pH | 7 (solução a 10%) |
Segurança e perigos do cloreto de potássio
O cloreto de potássio (KCl) apresenta riscos potenciais e preocupações de segurança que devem ser considerados ao manuseá-lo ou usá-lo. Isto pode causar irritação na pele e nos olhos, e a exposição prolongada pode resultar em queimaduras químicas. A inalação de poeira de KCl pode causar irritação respiratória e tosse. Além disso, a ingestão de grandes quantidades de KCl pode causar desequilíbrios eletrolíticos e arritmias cardíacas. É importante usar equipamento de proteção individual adequado, como luvas e proteção para os olhos, e manusear o KCl em uma área bem ventilada. Em caso de contato com a pele ou olhos, é importante enxaguar abundantemente a área afetada e consultar um médico se necessário.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Causa irritação na pele e nos olhos. Perigoso se ingerido. |
| UM ID | ONU1480 |
| Código SH | 310420 |
| Classe de perigo | 5.1 |
| Grupo de embalagem | II |
| Toxicidade | LD50 (rato, oral): 2.500 mg/kg |
Métodos de síntese de cloreto de potássio
Vários métodos podem sintetizar cloreto de potássio (KCl), incluindo:
- Solubilização e cristalização: Este método envolve dissolver o KCl em água e depois permitir que a solução evapore, deixando para trás cristais sólidos de KCl.
- Troca iônica: Para produzir KCl, os íons em uma solução de outro sal, como o cloreto de sódio, podem ser trocados por íons de potássio. As indústrias costumam usar esse método na produção de fertilizantes KCl.
- Eletrólise: A eletrólise de uma solução de KCl produz potássio elementar e cloro gasoso, que se combinam para formar KCl.
- Reação do hidróxido de potássio com ácido clorídrico : O hidróxido de potássio pode reagir com ácido clorídrico para produzir KCl e água.
- Reação do Carbonato de Potássio com Ácido Clorídrico: O carbonato de potássio pode reagir com ácido clorídrico para produzir KCl, dióxido de carbono e água.
Cada método tem suas próprias vantagens e desvantagens, e a escolha do método pode depender de fatores como a pureza necessária do produto, a escala de produção e o custo das matérias-primas e equipamentos.
Usos do cloreto de potássio
O cloreto de potássio tem uma ampla gama de utilizações, incluindo:
- Fertilizante: Usado como fertilizante para fornecer nutrientes essenciais para o crescimento das plantas.
- Aditivo alimentar: Utilizado como substituto do sal em alimentos processados para reduzir a ingestão de sódio.
- Tratamento de Água: Adicionado aos sistemas de tratamento de água para evitar corrosão e formação de incrustações.
- Aplicações Médicas: Usado em fluidos intravenosos e soluções de reidratação oral para repor eletrólitos e tratar condições como hipocalemia.
- Aplicações industriais: Utilizado na produção de vidros, cerâmicas e sabões, e como matéria-prima na produção de outros produtos químicos.
- Alimentação Animal: Adicionado à alimentação animal para fornecer nutrientes essenciais.
- Agente de degelo: Usado como agente de degelo para derreter gelo e neve em estradas e calçadas.
- Perfuração de petróleo e gás: Usado como estabilizador de argila em operações de perfuração de petróleo e gás.
- Reagente de Laboratório: Utilizado como reagente em experimentos e análises laboratoriais.
Questões:
P: O que é cloreto de potássio?
R: O cloreto de potássio (KCl) é um sal cristalino branco composto de íons potássio e cloro. Tem muitas aplicações em indústrias como agricultura, alimentos, medicamentos e fabricação de produtos químicos.
P: Para que é usado o cloreto de potássio?
R: O cloreto de potássio é comumente usado como fertilizante, aditivo alimentar e em aplicações médicas para tratar doenças como hipocalemia. Também pode ser utilizado em tratamento de água, processos industriais, alimentação animal, descongelamento, perfuração de petróleo e gás e experimentos de laboratório.
P: O cloreto de potássio é seguro?
R: O cloreto de potássio pode ser prejudicial se ingerido em grandes quantidades ou se entrar em contato com os olhos ou a pele. É importante seguir as diretrizes e regulamentos de segurança adequados ao manusear ou usar cloreto de potássio.
P: O KCl é solúvel em água?
R: Sim, o KCl é altamente solúvel em água. À temperatura ambiente, um grama de KCl pode dissolver-se em 1,5 ml de água.
P: O KCl é iônico ou covalente?
R: KCl é um composto iônico porque é composto de íons de potássio com carga positiva e íons de cloreto com carga negativa que são mantidos juntos por ligações iônicas.
P: O KCl é um ácido ou uma base?
R: O cloreto de potássio é um composto neutro e não é ácido nem base.
P: O KCl é um eletrólito forte?
R: Sim, o KCl é um eletrólito poderoso porque se dissocia completamente em íons potássio e cloreto quando dissolvido em água, permitindo a condutividade elétrica.
