O cloreto de ouro (AuCl3) é um composto formado pela combinação de ouro com cloro. É usado em uma variedade de aplicações, incluindo folheamento de ouro e como catalisador em reações químicas.
| Nome IUPAC | Cloreto de ouro (III) |
| Fórmula molecular | AuCl3 |
| Número CAS | 13453-07-1 |
| Sinônimos | Cloreto áurico, Triclorogold, Tricloreto de ouro |
| InChI | InChI=1S/3ClH.Au/h3*1H;/q;;;+3/p-3 |
Propriedades do cloreto de ouro
Fórmula de Cloreto de Ouro
A fórmula do tricloreto de ouro é AuCl3. É um composto químico composto por um átomo de ouro (Au) e três átomos de cloro (Cl). Esta fórmula representa a estequiometria dos elementos presentes no tricloreto de ouro.
Massa molar de cloreto de ouro
A massa molar do tricloreto de ouro é calculada somando as massas atômicas de seus elementos constituintes. Para o tricloreto de ouro (AuCl3), a massa molar é de aproximadamente 303,33 g/mol. É útil para determinar a quantidade de substância numa determinada amostra.
Ponto de ebulição do cloreto de ouro
O tricloreto de ouro tem um ponto de ebulição de aproximadamente 254°C (graus Celsius). A esta temperatura, o composto passa do estado líquido para o gasoso. O ponto de ebulição indica a temperatura na qual a pressão de vapor do líquido é igual à pressão atmosférica.
Ponto de fusão do cloreto de ouro
O ponto de fusão do tricloreto de ouro é de aproximadamente 254°C (graus Celsius). Esta é a temperatura na qual a forma sólida do composto se transforma em líquido. Compreender o ponto de fusão é essencial em diversos processos industriais.
Densidade de cloreto de ouro g/mL
A densidade do tricloreto de ouro é de aproximadamente 4,7 g/mL (gramas por mililitro). Densidade é a medida da massa por unidade de volume de uma substância. A densidade relativamente alta do tricloreto de ouro o torna mais pesado que a água.
Peso molecular do cloreto de ouro
O peso molecular do tricloreto de ouro, também conhecido como massa molar, é de aproximadamente 303,33 g/mol (gramas por mol). É a soma dos pesos atômicos de todos os átomos do composto. O peso molecular é crucial em cálculos químicos.
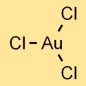
Estrutura do cloreto de ouro
O tricloreto de ouro (AuCl3) possui uma estrutura molecular que consiste em um átomo de ouro ligado a três átomos de cloro. O arranjo forma uma forma trigonal plana, com o átomo de ouro no centro e os átomos de cloro ao seu redor.
Solubilidade do cloreto de ouro
O tricloreto de ouro tem solubilidade limitada em água. Dissolve-se melhor em certos solventes orgânicos, como etanol e clorofórmio. A solubilidade do tricloreto de ouro é influenciada por fatores como a temperatura e a natureza do solvente.
| Aparência | Sólido amarelo |
| Gravidade Específica | ~4,7g/mL |
| Cor | AMARELO |
| Cheiro | Inodoro |
| Massa molar | ~303,33 g/mol |
| Densidade | ~4,7g/mL |
| Ponto de fusão | ~254°C |
| Ponto de ebulição | ~254°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Solubilidade limitada |
| Solubilidade | Solúvel em alguns solventes orgânicos, como etanol e clorofórmio |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | Não disponível |
| pH | Neutro (pH 7) |
Segurança e perigos do cloreto de ouro
O tricloreto de ouro apresenta riscos potenciais à segurança e requer manuseio cuidadoso. É essencial usar equipamentos de proteção adequados, como luvas e óculos de segurança, para evitar contato com a pele e irritação nos olhos. A inalação de poeira ou vapor deve ser evitada devido a possíveis problemas respiratórios. Além disso, a exposição a altas temperaturas pode resultar na liberação de gás cloro tóxico. O composto também é incompatível com agentes redutores fortes, o que pode levar a reações perigosas. São necessárias medidas adequadas de armazenamento, rotulagem e contenção para prevenir acidentes. Compreender esses perigos e precauções de segurança é crucial ao trabalhar com tricloreto de ouro em laboratório ou ambiente industrial.
| Símbolos de perigo | Perigo |
| Descrição de segurança | Manuseie com cuidado. Evitar o contato com a pele e os olhos. Não inale poeira ou vapores. Manter afastado de agentes redutores fortes. |
| Números de identificação da ONU | Não disponível |
| Código SH | 2843,29 |
| Classe de perigo | 6.1 (Substâncias tóxicas) |
| Grupo de embalagem | II |
| Toxicidade | Muito tóxico se ingerido ou inalado. Pode causar irritação na pele e nos olhos. |
Métodos para a síntese de cloreto de ouro
Vários métodos permitem a síntese de tricloreto de ouro.
Uma abordagem comum é dissolver ouro ou óxido de ouro em ácido clorídrico (HCl) . A reação produz tricloreto de ouro e água. Outro método envolve a reação do ouro com cloro gasoso, formando diretamente o tricloreto de ouro. Alternativamente, o gás cloro pode reagir com ouro metálico na presença de um catalisador como o cloreto de ferro, produzindo tricloreto de ouro e cloreto de ferro como subprodutos.
Outra rota de síntese envolve a reação do ouro metálico com água régia, uma mistura de ácido nítrico concentrado (HNO3) e ácido clorídrico . As poderosas propriedades oxidantes da Aqua regia convertem o ouro em tricloreto de ouro, que pode ser isolado por evaporação. O tricloreto de ouro é formado quando o ácido clorídrico reage com o óxido de ouro (III) (Au2O3), produzindo tricloreto de ouro e água.
Vários agentes redutores, como cloreto de estanho (II) (SnCl2) ou dióxido de enxofre (SO2), podem reduzir ativamente o cloreto de ouro (V) (AuCl5) para sintetizar tricloreto de ouro. A reação produz tricloreto de ouro e o cloreto do agente redutor correspondente.
Cada método tem suas vantagens e aplicabilidade, dependendo das matérias-primas disponíveis e da pureza desejada do tricloreto de ouro. A consideração cuidadosa das condições de reação e medidas de segurança é crucial durante o processo de síntese.
Usos do cloreto de ouro
O tricloreto de ouro encontra diversas aplicações devido às suas propriedades únicas:
- Chapeamento de Ouro: O tricloreto de ouro serve como fonte de íons de ouro para processos de galvanoplastia, permitindo que uma fina camada de ouro seja depositada nas superfícies. Isto melhora a condutividade e proporciona um acabamento atraente e resistente à corrosão.
- Catalisador: O tricloreto de ouro atua como catalisador em diversas reações químicas, principalmente na síntese orgânica. Sua capacidade de ativar certas conexões o torna valioso para promover reações específicas.
- Medicina: Os pesquisadores exploraram compostos de tricloreto de ouro para potenciais aplicações terapêuticas no tratamento de artrite e outras doenças inflamatórias.
- Fotografia: Na fotografia, o tricloreto de ouro é usado como toner, conferindo cores roxas e marrons às impressões em preto e branco.
- Vidro e cerâmica: A indústria do vidro utiliza o tricloreto de ouro para produzir o vidro rubi, conferindo-lhe a cor vermelha, e a cerâmica se beneficia do seu uso para realçar a coloração.
- Nanotecnologia: O tricloreto de ouro desempenha um papel crucial na nanotecnologia, facilitando a síntese de nanopartículas de ouro, que têm aplicações em eletrônica, catálise e imagens médicas.
- Agente antibacteriano: Nanopartículas de tricloreto de ouro têm se mostrado promissoras como agentes antibacterianos, inibindo efetivamente o crescimento de certas bactérias.
- Conservação de Arte: Na restauração de arte, os especialistas usam tricloreto de ouro para dourar e recriar pigmentos históricos.
- Reagente de Laboratório: Os cientistas o utilizam como reagente de laboratório para diversas análises químicas e fins de pesquisa.
- Tintas Metálicas: Os fabricantes usam tintas de tricloreto de ouro para fins de impressão, infundindo um toque de luxo em produtos como papelaria e embalagens.
Devido à sua versatilidade e propriedades únicas, o tricloreto de ouro continua a ser relevante em diversas indústrias, desempenhando um papel importante na tecnologia, arte, medicina e ciência dos materiais.
Questões:
P: Que produto químico posso usar para precipitar ouro a partir do cloreto de ouro?
R: O metabissulfito de sódio (Na2S2O5) pode ser usado como agente redutor para precipitar ouro a partir de soluções de tricloreto de ouro.
P: O ouro monoatômico está contido no cloreto de ouro?
R: Não, o ouro monoatômico não é tricloreto de ouro; é uma forma distinta de ouro composta de átomos individuais, não em estado composto.
P: Qual é a massa molar do cloreto de ouro III?
R: A massa molar do tricloreto de ouro III (AuCl3) é de aproximadamente 303,33 g/mol.
P: O que é cloreto de ouro?
R: O tricloreto de ouro (AuCl3) é um composto químico formado pela combinação de ouro com cloro, usado em diversas aplicações, como folheamento de ouro e catálise.
P: Como fazer cloreto estanoso para testar ouro?
R: O cloreto estanoso (SnCl2) pode ser preparado dissolvendo o estanho metálico em ácido clorídrico (HCl), seguido de redução.
P: Qual é a massa molar do AuCl3?
R: A massa molar do AuCl3 (tricloreto de ouro III) é de aproximadamente 303,33 g/mol.
P: Qual é a porcentagem de ouro no AuCl3?
R: A porcentagem de ouro no AuCl3 é de aproximadamente 42,49%.
P: Quantos mols de H2O existem em 3,4 g de AuCl3 · 2 H2O?
R: Existem 0,0349 moles de H2O em 3,4 g de AuCl3 · 2 H2O.
P: O AuCl3 é solúvel em água?
R: Sim, AuCl3 (tricloreto de ouro III) é até certo ponto solúvel em água.
P: Quantos gramas de ouro podem ser recuperados de 35g de AuCl3?
R: Cerca de 14,87 gramas de ouro podem ser recuperados de 35 g de AuCl3.
P: Qual é a solubilidade molar do AuCl3? Kps = 3,2 × 10−25
A: A solubilidade molar de AuCl3, dado Ksp = 3,2 × 10−25, é aproximadamente 1,8 × 10^-9 mol/L.
