O cloreto de níquel (II), conhecido como NiCl2, é um composto químico amarelo-esverdeado. É comumente usado em galvanoplastia, catalisadores e como precursor na síntese de outros compostos de níquel.
| Nome da IUPAC | Cloreto de níquel (II) |
| Fórmula molecular | NiCl2 |
| Número CAS | 7718-54-9 |
| Sinônimos | Cloreto de níquel, dicloreto de níquel, dicloroníquel, cloreto de níquel |
| InChI | InChI=1S/2ClH.Ni/h2*1H;/q;;+2/p-2 |
Propriedades do cloreto de níquel
Fórmula de cloreto de níquel
A fórmula do dicloreto de níquel é NiCl2. Isto indica que cada molécula de dicloreto de níquel consiste em um átomo de níquel ligado a dois átomos de cloro. Esta fórmula química fornece informações importantes sobre a composição e proporção dos elementos presentes no composto.
Massa molar de cloreto de níquel
A massa molar do dicloreto de níquel, calculada pela soma das massas atômicas de seus elementos constituintes, é de aproximadamente 129,6 gramas por mol. Este valor é útil para determinar a quantidade de dicloreto de níquel presente em uma determinada amostra e para vários cálculos estequiométricos.
Ponto de ebulição do cloreto de níquel
O dicloreto de níquel tem um ponto de ebulição de cerca de 1.007 graus Celsius (1.845 graus Fahrenheit). A esta temperatura, o composto sofre uma transição de fase do estado líquido para o estado gasoso. O ponto de ebulição é uma propriedade física importante que ajuda a compreender o comportamento do dicloreto de níquel quando aquecido.
Ponto de fusão do cloreto de níquel
O ponto de fusão do dicloreto de níquel é de aproximadamente 1.002 graus Celsius (1.836 graus Fahrenheit). Esta é a temperatura na qual a forma sólida do dicloreto de níquel muda para o estado líquido. O ponto de fusão é importante para aplicações que envolvem o manuseio e processamento de dicloreto de níquel.
Densidade de cloreto de níquel g/mL
A densidade do dicloreto de níquel é de aproximadamente 3,55 gramas por mililitro. A densidade é uma medida da massa por unidade de volume de uma substância e fornece informações sobre a compactação do material. A densidade do dicloreto de níquel ajuda a determinar seu comportamento em diversas aplicações e em diferentes estados físicos.
Peso molecular do cloreto de níquel
O peso molecular do dicloreto de níquel é de aproximadamente 129,6 gramas por mol. É calculado adicionando as massas atômicas de níquel e cloro no composto. O peso molecular é essencial para compreender as relações entre massa, moles e número de partículas em reações químicas.
Estrutura do cloreto de níquel
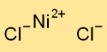
O dicloreto de níquel adota uma estrutura cristalina em sua forma sólida. Consiste em cátions de níquel (Ni2+) e ânions cloreto (Cl-) dispostos alternadamente. Este arranjo forma uma rede tridimensional que contribui para a estabilidade e propriedades físicas do dicloreto de níquel.
Solubilidade do cloreto de níquel
O dicloreto de níquel tem solubilidade moderada em água. Pode dissolver-se para formar uma solução amarelo-esverdeada. A solubilidade do dicloreto de níquel é influenciada por fatores como temperatura e presença de outras substâncias. Compreender sua solubilidade é importante em diversos processos industriais e aplicações químicas envolvendo dicloreto de níquel.
| Aparência | Sólido amarelo esverdeado |
| Gravidade Específica | 3,55g/ml |
| Cor | amarelo esverdeado |
| Cheiro | Inodoro |
| Massa molar | 129,6 g/mol |
| Densidade | 3,55g/ml |
| Ponto de fusão | 1002°C (1836°F) |
| Ponto de ebulição | 1007°C (1845°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Moderado |
| Solubilidade | Solúvel em solventes orgânicos (etanol, acetona) e ácidos |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | Não disponível |
| pH | Ácido (cerca de 4) |
Segurança e perigos do cloreto de níquel
O dicloreto de níquel apresenta certos riscos de segurança que precisam ser considerados. É importante manusear este composto com cuidado para evitar riscos potenciais. O dicloreto de níquel pode causar irritação e sensibilização da pele, portanto, luvas e roupas de proteção devem ser usadas ao manuseá-lo. A inalação de pó ou vapor de dicloreto de níquel deve ser evitada, pois pode causar irritação respiratória. A ingestão de dicloreto de níquel pode ser prejudicial e deve ser evitada. Além disso, o dicloreto de níquel é tóxico para a vida aquática e pode causar danos ambientais se liberado em corpos d’água. Procedimentos adequados de armazenamento, manuseio e descarte devem ser seguidos para minimizar os riscos associados ao dicloreto de níquel.
| Símbolos de perigo | Corrosivo, prejudicial e perigoso para o meio ambiente |
| Descrição de segurança | – Use luvas e roupas de proteção – Evite a inalação de poeira ou vapor – Evite a ingestão – Armazene, manuseie e descarte adequadamente |
| Identificadores das Nações Unidas | UN3288 |
| Código SH | 2827.39.80 |
| Classe de perigo | 8 (Corrosivo) |
| Grupo de embalagem | III |
| Toxicidade | Nocivo se ingerido, causa irritação na pele e nos olhos |
Métodos de síntese de cloreto de níquel
Existem vários métodos para sintetizar dicloreto de níquel, cada um com suas vantagens e aplicações.
Um método comum envolve a reação de níquel metálico ou óxido de níquel com ácido clorídrico. Neste processo, o níquel metálico ou óxido de níquel é adicionado a um recipiente adequado e agitado enquanto se adiciona lentamente ácido clorídrico. A reação entre o níquel e o ácido produz dicloreto de níquel, bem como a liberação de gás hidrogênio.
Outro método de síntese envolve a reação entre carbonato de níquel e ácido clorídrico. O ácido clorídrico dissolve o carbonato de níquel e a solução aquecida sofre uma reação para formar dicloreto de níquel e liberar gás dióxido de carbono.
O ácido clorídrico reage com o hidróxido de níquel dissolvido quando a solução é aquecida ou deixada em repouso, resultando na síntese do dicloreto de níquel. A reação leva à formação de dicloreto de níquel e água.
Além disso, o dicloreto de níquel pode ser preparado pela reação do níquel metálico com cloro gasoso. Esta reação direta entre os dois elementos dá dicloreto de níquel.
Esses métodos de síntese oferecem diferentes rotas para obtenção de dicloreto de níquel, permitindo flexibilidade em termos de matérias-primas e condições de reação. A escolha do método depende de fatores como a pureza desejada do produto final, disponibilidade de matéria-prima e requisitos específicos de aplicação.
Usos do cloreto de níquel
O dicloreto de níquel tem diversas aplicações em diferentes indústrias devido às suas propriedades únicas. Aqui estão alguns de seus usos notáveis:
- Galvanoplastia: Os processos de galvanoplastia normalmente usam dicloreto de níquel para fornecer um revestimento protetor e decorativo em várias superfícies. O dicloreto de níquel melhora a aparência de metais como aço, latão e cobre, ao mesmo tempo que proporciona resistência à corrosão.
- Catalisador: O dicloreto de níquel atua como catalisador em muitas reações químicas, incluindo processos de hidrogenação e polimerização. Facilita a conversão de reagentes em produtos desejados e tem aplicação na produção de produtos farmacêuticos, plásticos e fibras sintéticas.
- Síntese química: O dicloreto de níquel serve como precursor na síntese de vários compostos de níquel, como óxido de níquel, sulfeto de níquel e cianeto de níquel. As indústrias utilizam esses compostos em catalisadores, pigmentos, cerâmicas e materiais magnéticos.
- Baterias: As baterias recarregáveis, especialmente as baterias de níquel-hidreto metálico (NiMH), usam dicloreto de níquel como eletrólito. Permite a circulação de íons entre os eletrodos durante os ciclos de carga e descarga.
- Purificação de Gás: As indústrias usam dicloreto de níquel em processos de purificação de gás para remover impurezas como sulfeto de hidrogênio e monóxido de carbono. Encontra aplicações no refino de gás natural e no processamento petroquímico.
- Suplemento de alimentação animal: A alimentação de gado, principalmente de aves e suínos, incorpora dicloreto de níquel como suplemento nutricional. Facilita a atividade enzimática e contribui para a saúde geral e o crescimento dos animais.
- Pesquisa laboratorial: Os pesquisadores usam dicloreto de níquel em uma variedade de experimentos de laboratório, inclusive em reações catalisadas por níquel e como fonte de íons de níquel para análises químicas.
Estas diversas aplicações demonstram a versatilidade e a importância do dicloreto de níquel em setores que vão desde a indústria transformadora e energia até à agricultura e investigação.
Questões:
P: Quais íons estão presentes em uma solução aquosa de NiCl2?
R: Em uma solução aquosa de NiCl2, os íons presentes são Ni2+ (cátion níquel) e Cl- (ânion cloreto).
P: O NiCl2 é solúvel em água?
R: Sim, o NiCl2 é solúvel em água e forma uma solução aquosa amarelo-esverdeada.
P: Qual metal reage espontaneamente com NiCl2(aq)?
R: Metais como magnésio (Mg) e zinco (Zn) reagem espontaneamente com NiCl2(aq) para deslocar o níquel e formar seus respectivos cloretos.
P: O NiCl2 é polar ou apolar?
R: NiCl2 é um composto polar devido à diferença de eletronegatividade entre o níquel e o cloro, o que resulta em uma distribuição desigual de carga.
P: O NiCl2 é aquoso?
R: Sim, o NiCl2 pode existir em estado aquoso quando dissolvido em água, formando uma solução aquosa.
P: Qual é o nome do composto com a fórmula NiCl2?
R: O composto com a fórmula NiCl2 é denominado cloreto de níquel (II).
P: Como você prepararia 1,00 L de uma solução 0,50 M de NiCl2?
R: Para preparar uma solução 0,50 M de NiCl2, dissolva 129,6 gramas de NiCl2 em água e aumente o volume para 1,00 L.
P: Qual é o sal insolúvel formado entre uma solução de Na2S e NiCl2?
R: Quando uma solução de Na2S é misturada com NiCl2, forma-se sulfeto de níquel insolúvel (NiS).
P: NiCl2(aq) é um sólido?
R: Não, NiCl2(aq) refere-se a uma solução aquosa de NiCl2, o que indica que está na forma líquida.
P: O que torna o cloreto de níquel (II) cristalino verde?
R: A cor verde do cloreto de níquel (II) cristalino é atribuída à presença de cátions de níquel (Ni2+) na rede cristalina.
P: O dicloreto de níquel é tóxico?
R: Sim, o dicloreto de níquel é tóxico e deve ser manuseado com cautela. Pode causar irritação na pele e problemas respiratórios e é prejudicial se ingerido.
P: Ocorre uma reação quando soluções aquosas de NiCl2 e Na2S são combinadas?
R: Sim, ocorre uma reação quando soluções aquosas de NiCl2 e Na2S são combinadas, resultando na formação de sulfeto de níquel insolúvel (NiS) e cloreto de sódio solúvel (NaCl).
P: Quantos gramas de NiCl2 são necessários para neutralizar 75,0 mL de hidróxido de lítio 0,555 M?
R: Aproximadamente 18,4 gramas de NiCl2 são necessários para neutralizar 75,0 ml de hidróxido de lítio 0,555 M em uma reação estequiométrica.
P: O que acontece quando você mistura carbonato de amônio, dicloreto de níquel e água?
R: Quando carbonato de amônio, dicloreto de níquel e água são misturados, ocorre uma reação que resulta na formação de cloreto de amônio, carbonato de níquel e água.
