O cloreto de cálcio é um composto inorgânico altamente solúvel com a fórmula CaCl2. É comumente usado como agente descongelante, dessecante e na produção de sais de cálcio e produtos químicos.
| Nome IUPAC | Cloreto de cálcio |
| Fórmula molecular | CaCl2 |
| Número CAS | 10043-52-4 |
| Sinônimos | Dicloreto de cálcio, cloreto de cálcio (II) |
| E509, sal de decapagem, Dowflake, Peladow, TETRA | |
| InChI | InChI=1S/Ca.2ClH/h;2*1H/q+2;;/p-2 |
Fórmula de cloreto de cálcio
A fórmula química do cloreto de cálcio é CaCl2. Isso significa que cada unidade de cloreto de cálcio é composta por um íon cálcio (Ca2+) e dois íons cloreto (Cl-). O cloreto de cálcio é um composto iônico, o que significa que é mantido unido pela atração eletrostática entre o íon cálcio carregado positivamente e os íons cloreto carregados negativamente.
Massa molar de cloreto de cálcio
O cloreto de cálcio tem massa molar de 110,98 g/mol, que corresponde à soma das massas atômicas de um átomo de Ca e dois átomos de Cl. É um composto inorgânico altamente solúvel em água. água e comumente usado como agente de secagem, dessecante e agente de degelo. O cloreto de cálcio também é utilizado na produção de sais de cálcio e outros produtos químicos.
Ponto de ebulição do CaCl2
O ponto de ebulição do CaCl2 é 1935°C, o que é muito alto para um composto inorgânico. Isto se deve às fortes ligações iônicas entre os íons Ca+2 e Cl-, que requerem muita energia para serem quebradas. CaCl2 é um composto higroscópico, o que significa que absorve a umidade do ar e pode se dissolver em água para formar uma solução altamente concentrada.
Ponto de fusão do CaCl2
CaCl2 tem um ponto de fusão de 772°C. Possui estrutura cristalina e geralmente é encontrado na forma anidra, o que significa que não contém moléculas de água. Quando o CaCl2 é aquecido, ele se decompõe em óxido de cálcio e cloreto de hidrogênio gasoso.
Densidade de CaCl2 g/ml
A densidade do CaCl2 depende da concentração da solução. Uma solução 1 M de CaCl2 tem uma densidade de aproximadamente 1,4 g/mL, enquanto uma solução 3 M tem uma densidade de aproximadamente 1,6 g/mL. A densidade do CaCl2 sólido é 2,15 g/cm³.
Peso molecular de CaCl2
O peso molecular do CaCl2 é 110,98 g/mol. É um composto inorgânico composto por um átomo de Ca e dois átomos de Cl. CaCl2 é um sólido cristalino branco à temperatura ambiente e é altamente solúvel em água.
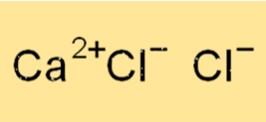
Estrutura do CaCl2
CaCl2 tem uma estrutura cristalina, que é mantida unida por ligações iônicas entre o cátion cálcio (Ca2+) e o ânion cloreto (Cl-). Cada íon Ca+2 está rodeado por seis íons Cl- e cada íon cloreto está rodeado por seis íons cálcio. A estrutura cristalina do CaCl2 é cúbica, com cada célula unitária contendo um íon cálcio e dois íons cloreto.
| Aparência | Sólido branco |
| Gravidade Específica | 2,15 (sólido), 1,4-1,6 (solução) |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 110,98 g/mol |
| Densidade | 2,15 g/cm³ (sólido), 1,4-1,6 g/cm³ (solução) |
| Ponto de fusão | 772°C |
| Ponto de ebulição | 1935°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel em água |
| Solubilidade | Solúvel em etanol e acetona |
| Pressão de vapor | Insignificante |
| Densidade do vapor | Não aplicável |
| pKa | – |
| pH | 4,5-11,0 (solução a 10%) |
Segurança e perigos do cloreto de cálcio
O CaCl2 pode causar irritação na pele e nos olhos, e a inalação de poeira ou névoa pode causar irritação respiratória. Também pode causar queimaduras se entrar em contato com a pele ou os olhos. CaCl2 é higroscópico, o que significa que pode absorver umidade e liberar calor, o que pode causar a ruptura ou explosão dos recipientes. Também é corrosivo para certos metais e pode reagir com certos materiais orgânicos. Equipamento de proteção adequado, como luvas e óculos de proteção, deve ser usado ao manusear CaCl2. Os derramamentos devem ser limpos imediatamente e os recipientes armazenados em área fresca, seca e bem ventilada.
| Símbolos de perigo | Corrosivo, Irritante |
| Descrição de segurança | Use luvas de proteção e proteção para os olhos/face. Não inale poeiras/fumos/gases/névoas/vapores. |
| Números de identificação da ONU | ONU 3077, ONU 1786 (onça hidratada) |
| Código SH | 2827.39.90 |
| Classe de perigo | 8 (Substâncias corrosivas) |
| Grupo de embalagem | III |
| Toxicidade | A toxicidade é baixa para a maioria das aplicações, mas pode ser perigosa em grandes quantidades |
Métodos para a síntese de cloreto de cálcio
Para sintetizar CaCl2, vários métodos estão disponíveis.
Um método envolve a reação de carbonato de cálcio ou hidróxido de cálcio com ácido clorídrico . Um método é adicionar carbonato de cálcio ou hidróxido de cálcio ao ácido clorídrico . A solução evapora para dar CaCl2.
Outro método é reagir o óxido de cálcio com ácido clorídrico . Este método envolve a adição de óxido de cálcio ao ácido clorídrico e depois a evaporação da solução para obter CaCl2.
Um terceiro método envolve a reação do cálcio metálico com cloro gasoso. Um método menos comum é aquecer cálcio metálico na presença de cloro gasoso. A reação produz CaCl2, mas os especialistas não utilizam essa abordagem com frequência devido à alta reatividade do cálcio metálico e à necessidade de manuseio especializado.
Para produzir CaCl2 por um método diferente, pode-se utilizar o subproduto do processo Solvay, que gera cloreto de sódio e CaCl2. O processo envolve a extração de CaCl2 do subproduto por meio de técnicas de filtração, evaporação e purificação. Essas etapas ajudam a remover todas as impurezas e a produzir CaCl2 de alta pureza.
Usos do cloreto de cálcio
CaCl2 tem muitas aplicações industriais:
- Usado como dessecante para absorver umidade, agente descongelante para estradas e calçadas e coagulante na produção de tofu e outros alimentos.
- Usado na indústria de petróleo e gás para aumentar a densidade dos fluidos de perfuração e reduzir o ponto de congelamento da água nas tubulações.
- Utilizado em misturas de concreto para acelerar o processo de cura e aumentar a resistência e durabilidade do produto acabado.
- Usado na produção de papel para aumentar a resistência e estabilidade das fibras de papel.
- Usado no tratamento de água para remover impurezas e amaciar a água.
- Usado como fonte de íons de cálcio em aplicações médicas, como fluidos intravenosos e para tratar hipocalcemia.
- Utilizado na produção de plásticos e borracha para aumentar a dureza e durabilidade do produto final.
- Utilizado na conservação de frutas e vegetais para evitar que se estraguem e manter a textura e o sabor do produto.
- Usado na produção têxtil para melhorar a absorção de corantes e aumentar a resistência e flexibilidade da fibra.
- Também utilizado na produção de extintores de incêndio e como componente de materiais retardadores de chamas para evitar a propagação de chamas.
Questões:
P: O que é cloreto de cálcio?
R: O cloreto de cálcio é um composto químico composto por íons Ca2+ e Cl- com a fórmula química CaCl2.
P: O cloreto de cálcio é iônico ou covalente?
R: CaCl2 é um composto iônico porque é composto de íons Ca2+ carregados positivamente e íons Cl- carregados negativamente, mantidos juntos por ligações iônicas.
P: Para que é usado o cloreto de cálcio?
R: O CaCl2 tem muitos usos industriais, comerciais e médicos, inclusive como dessecante, agente de degelo, coagulante na produção de alimentos, acelerador em concreto, amaciante de água e fonte de íons de cálcio em tratamentos médicos.
P: Qual é a fórmula do cloreto de cálcio?
R: A fórmula do cloreto de cálcio é CaCl2, o que indica que cada molécula contém um íon cálcio e dois íons cloreto.
P: O CaCl2 é iônico ou covalente?
R: CaCl2 é um composto iônico porque é composto de íons de cálcio com carga positiva e íons de cloreto com carga negativa, mantidos juntos por ligações iônicas.
P: O CaCl2 é solúvel em água?
R: Sim, o CaCl2 é altamente solúvel em água, o que significa que pode facilmente se dissolver em água para formar uma solução transparente.
P: Se o CaCl2 for dissolvido em água, o que podemos dizer sobre a concentração do íon Ca2+?
R: Quando o CaCl2 é dissolvido em água, ele se dissocia em seus íons constituintes, Ca2+ e 2Cl-. Como o CaCl2 se dissocia completamente em água, a concentração de íons Ca2+ em solução é duas vezes a concentração de CaCl2.
