O cloreto de bário di-hidratado é um composto cristalino branco com a fórmula química BaCl2·2H2O. É comumente utilizado em laboratório como reagente e na indústria para o tratamento de superfícies metálicas.
| Nome IUPAC | Cloreto de bário di-hidratado |
| Fórmula molecular | BaCl2·2H2O |
| Número CAS | 10326-27-9 |
| Sinônimos | Dicloreto de bário di-hidratado; Cloreto de bário(II) di-hidratado; Cloreto de bário hidratado (1:2:2); Cloreto de bário 2-hidratado; Cloreto de bário di-hidratado; Dicloreto de bário di-hidratado; Cloreto de bário (2+) di-hidratado |
| InChI | InChI=1S/Ba.2ClH.2H2O/h;21H;21H2/q+2;;;/p-2 |
Massa molar BaCl2·2H2O
A massa molar do cloreto de bário di-hidratado (BaCl2·2H2O) é 244,26 g/mol. Este valor pode ser calculado somando as massas atômicas de cada elemento presente no composto. O bário tem massa molar de 137,33 g/mol, o cloro tem massa molar de 35,45 g/mol e o hidrogênio e o oxigênio têm massas molares de 1,01 g/mol e 16,00 g/mol, respectivamente. As duas moléculas de água adicionam outros 36,02 g/mol. A massa molar de BaCl2·2H2O é importante em cálculos estequiométricos onde a quantidade de reagente ou produto é expressa em moles.
Fórmula de cloreto de bário di-hidratado
A fórmula química do cloreto de bário di-hidratado é BaCl2·2H2O. Esta fórmula indica que cada unidade de fórmula do composto contém um íon bário, dois íons cloreto e duas moléculas de água. A fórmula é importante para cálculos estequiométricos e para a compreensão das propriedades químicas e físicas do composto.
Ponto de ebulição do cloreto de bário di-hidratado
BaCl2·2H2O tem um ponto de ebulição de 1560°C. A esta temperatura, o composto passará por uma transição de fase de líquido para gás. O alto ponto de ebulição se deve à natureza iônica do composto, que requer uma grande quantidade de energia para quebrar as fortes forças eletrostáticas que mantêm os íons unidos. BaCl2·2H2O é utilizado na indústria como agente de tratamento térmico para superfícies metálicas devido aos seus altos pontos de fusão e ebulição.
Ponto de fusão do cloreto de bário di-hidratado
O ponto de fusão do BaCl2 · 2H2O é 962 °C. A esta temperatura, o composto mudará de sólido para líquido. O alto ponto de fusão do BaCl2·2H2O é devido às fortes ligações iônicas entre os íons de bário e cloro, bem como às ligações de hidrogênio entre as moléculas de água. O ponto de fusão do BaCl2·2H2O é uma propriedade importante para sua utilização em diversas aplicações, como produção de pigmentos e corantes e tratamento de superfícies metálicas.
Densidade de cloreto de bário di-hidratado g/ml
A densidade do cloreto de bário di-hidratado é 3,097 g/cm³. Isso significa que 1 cm³ de cloreto de bário di-hidratado pesa 3,097 gramas. A densidade de uma substância é uma propriedade importante que pode fornecer informações sobre suas propriedades físicas e químicas. No caso do cloreto de bário di-hidratado, a alta densidade se deve à massa atômica relativamente grande do bário e ao empacotamento próximo de íons na estrutura da rede cristalina.
Peso molecular de BaCl2 · 2H2O
O peso molecular de BaCl2·2H2O é 244,26 g/mol. Este valor pode ser calculado somando os pesos atômicos de cada elemento presente no composto. O peso molecular é uma propriedade importante do BaCl2 · 2H2O porque é utilizado em diversas aplicações, como produção de pigmentos e corantes, e como reagente em experimentos de laboratório.
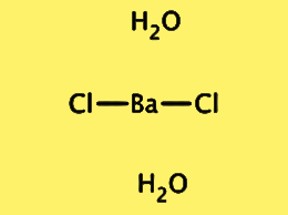
Estrutura BaCl2·2H2O
A estrutura cristalina do BaCl2·2H2O é ortorrômbica, com grupo espacial Pnma. A célula unitária contém uma unidade com a fórmula BaCl2·2H2O, composta por um íon bário, dois íons cloreto e duas moléculas de água. O íon bário é cercado por oito íons cloreto e as moléculas de água estão ligadas por ligações de hidrogênio aos íons cloreto. A estrutura cristalina do BaCl2 · 2H2O é importante para a compreensão de suas propriedades físicas e químicas, bem como para sua utilização em diversas aplicações.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 3,097g/cm³ |
| Cor | Incolor a branco |
| Cheiro | Inodoro |
| Massa molar | 244,26 g/mol |
| Densidade | 3,097g/cm³ |
| Ponto de fusão | 962°C |
| Ponto de ebulição | 1560°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 31,2 g/100 mL (a 20°C) |
| Solubilidade | Solúvel em álcool e acetona |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Neutro (7) |
Nota: A tabela pode não estar alinhada corretamente dependendo das configurações de exibição da plataforma ou dispositivo que você está usando.
Segurança e perigos do cloreto de bário di-hidratado
BaCl2 2H2O apresenta vários riscos à segurança e à saúde, que podem ser prejudiciais se não forem manuseados adequadamente. É uma substância corrosiva que pode causar queimaduras graves na pele e nos olhos ao entrar em contato. A inalação de poeira ou vapores pode causar problemas respiratórios e danos aos pulmões. Também é tóxico se ingerido e pode causar problemas gastrointestinais. BaCl2 · 2H2O deve ser manuseado com cautela e equipamentos de proteção adequados, como luvas, óculos de proteção e respiradores, devem ser usados ao trabalhar com o composto. Deve ser armazenado longe de substâncias incompatíveis e em área segura para evitar exposição acidental. Em caso de emergência, procure atendimento médico imediatamente.
| Símbolos de perigo | Corrosivo (C) | |
| Descrição de segurança | ||
| Identificadores AN | UN1564 | |
| Código SH | 28273990 | |
| Classe de perigo | 8 | |
| Grupo de embalagem | III | |
| Toxicidade | Tóxico se ingerido; pode causar problemas gastrointestinais. Corrosivo para a pele e os olhos. A inalação de poeira ou vapor pode causar problemas respiratórios e danos aos pulmões. | |
Métodos para a síntese de cloreto de bário di-hidratado
Você pode sintetizar BaCl2 · 2H2O por vários métodos.
Um método comum é reagir carbonato de bário ou hidróxido de bário com ácido clorídrico. Você deve evaporar a solução resultante para obter o composto sólido.
Outro método é reagir o sulfeto de bário com ácido clorídrico. Essa reação produz gás sulfeto de hidrogênio, que você deve descartar de maneira adequada. A solução obtida é então purificada por filtração e cristalização para obter o produto final.
Você também pode sintetizar BaCl2 · 2H2O por uma reação de precipitação usando cloreto de sódio e nitrato de bário. Você precisa misturar os dois compostos em uma solução, depois filtrar e secar o precipitado resultante para obter o composto sólido.
Além disso, BaCl2 · 2H2O pode ser sintetizado pela reação do óxido de bário com ácido clorídrico. Essa reação produz água como subproduto, que deve ser removida por evaporação. A solução obtida é então cristalizada para obter o produto final.
Ao trabalhar com BaCl2 · 2H2O, você deve tomar as devidas precauções de segurança, pois é um composto corrosivo e tóxico. Você deve usar equipamentos de proteção, como luvas, óculos de proteção e respiradores, e manusear o composto em uma área bem ventilada.
Usos do cloreto de bário di-hidratado
BaCl2 · 2H2O tem diversos usos em diversas indústrias.
- A indústria química utiliza BaCl2 · 2H2O como reagente em diversas reações químicas, como na produção de sais de bário, pigmentos e cerâmicas.
- Funciona como fluxo no refino de metais e como catalisador na síntese orgânica.
- A indústria médica utiliza BaCl2 · 2H2O como agente de contraste em radiografias e para tratar envenenamento por bário. Também é utilizado na fabricação de cimentos dentários.
- A indústria têxtil utiliza BaCl2 · 2H2O como mordente, substância que liga corantes às fibras, e como retardador de chama para têxteis.
- Na indústria petrolífera, BaCl2 · 2H2O é usado como aditivo à lama de perfuração para aumentar a densidade da lama e evitar explosões durante as operações de perfuração.
- A indústria alimentícia utiliza BaCl2 · 2H2O como conservante e intensificador de sabor para certos alimentos.
Precauções de segurança apropriadas, como usar equipamento de proteção e manusear o composto em uma área bem ventilada, devem ser tomadas para minimizar os riscos associados ao trabalho com o corrosivo e tóxico BaCl2 · 2H2O.
Questões:
Qual é a fórmula do cloreto de bário di-hidratado?
A fórmula do cloreto de bário di-hidratado é BaCl2·2H2O.
O cloreto de bário di-hidratado é solúvel em água?
Sim, o cloreto de bário di-hidratado é altamente solúvel em água. Dissolve-se facilmente em água, com solubilidade de aproximadamente 31,2 g/100 mL à temperatura ambiente. Esta alta solubilidade o torna um composto útil em diversas indústrias, como na produção de sais de bário e como aditivo de lama de perfuração na indústria do petróleo. Porém, sua alta solubilidade também significa que pode representar risco à saúde humana e ao meio ambiente se não for manuseado corretamente, pois pode contaminar mananciais e causar toxicidade a organismos aquáticos. Portanto, devem ser tomadas precauções adequadas ao trabalhar com BaCl2 · 2H2O para evitar contaminação e garantir um manuseio seguro.
