Cloreto de amônio ou NH4Cl é um sal cristalino branco usado em diversas aplicações, incluindo medicamentos e fertilizantes. É formado pela reação da amônia e do ácido clorídrico e possui um sabor salgado distinto.
| Nome IUPAC | Cloreto de amônio |
| Fórmula molecular | NH4Cl |
| Número CAS | 12125-02-9 |
| Sinônimos | Sal amônia, Salmiac, sal Nushadir, Amchlor, Sal armagnac, Hidroclorato, Muriato de amônio, Sal armagnac |
| InChI | InChI=1S/ClH.H3N/h1H;1H3 |
Massa molar NH4Cl
O cloreto de amônio tem massa molar de 53,49 g/mol. A massa molar refere-se à massa de um mol de uma substância e é expressa em gramas por mol (g/mol). A massa molar do cloreto de amônio é determinada pela adição das massas atômicas de seus átomos constituintes, que são nitrogênio (N), hidrogênio (H) e cloro (Cl). A fórmula molecular do cloreto de amônio é NH4Cl, o que significa que contém um átomo de nitrogênio, quatro átomos de hidrogênio e um átomo de cloro. Portanto, a massa molar do cloreto de amônio pode ser calculada da seguinte forma
Massa molar = (1 x massa atômica de N) + (4 x massa atômica de H) + (1 x massa atômica de Cl)
= (1 x 14,01 g/mol) + (4 x 1,01 g/mol) + (1 x 35,45 g/mol)
= 53,49 g/mol
Ponto de ebulição do cloreto de amônio
O ponto de ebulição do cloreto de amônio é 520°C (968°F). O ponto de ebulição é a temperatura na qual a pressão de vapor de um líquido é igual à pressão externa aplicada a ele. A esta temperatura, o cloreto de amônio evapora e se transforma em estado gasoso. O alto ponto de ebulição do cloreto de amônio é devido às suas fortes ligações iônicas entre os íons amônio (NH4+) e cloreto (Cl-).
Ponto de fusão do cloreto de amônio
O ponto de fusão do cloreto de amônio é 338°C (640°F). O ponto de fusão é a temperatura na qual um sólido se transforma em líquido. A esta temperatura, as ligações iônicas entre os íons amônio (NH4+) e cloreto (Cl-) são quebradas e o cloreto de amônio muda de sólido para líquido. O cloreto de amônio tem um ponto de fusão relativamente baixo em comparação com outros compostos iônicos, tornando-o útil em certas aplicações, como soldagem e metalurgia.
Densidade de cloreto de amônio g/ml
A densidade do cloreto de amônio é 1,527 g/cm³. A densidade é uma medida da quantidade de massa por unidade de volume de uma substância. A alta densidade do cloreto de amônio se deve à sua estrutura de rede iônica muito compacta. O cloreto de amônio tem uma densidade maior que a da água, o que significa que afundará na água.
Peso molecular do cloreto de amônio
O peso molecular do cloreto de amônio é 53,49 g/mol. O peso molecular é a soma dos pesos atômicos de todos os átomos de uma molécula. O peso molecular do cloreto de amônio é igual à sua massa molar.
Estrutura do cloreto de amônio
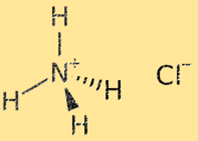
A estrutura do cloreto de amônio é uma rede cristalina composta por íons alternados de amônio (NH4+) e cloreto (Cl-). O íon amônio é um íon poliatômico com carga positiva (+1), consistindo de um átomo de nitrogênio e quatro átomos de hidrogênio. O íon cloreto é um íon monoatômico com carga negativa (-1), constituído por um átomo de cloro. A estrutura cristalina do cloreto de amônio é estabilizada por fortes ligações iônicas entre os íons amônio e cloreto, resultando em um sólido muito estável e quebradiço.
Fórmula de cloreto de amônio
A fórmula do cloreto de amônio é NH4Cl. É composto por um íon amônio (NH4+) e um íon cloreto (Cl-). A fórmula representa a proporção de átomos em uma molécula e mostra que para cada íon amônio existe um íon cloreto. A fórmula do cloreto de amônio é usada para determinar a massa molar, densidade e outras propriedades do composto.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 1.527g/cm³ |
| Cor | Incolor a branco |
| Cheiro | Inodoro |
| Massa molar | 53,49 g/mol |
| Densidade | 1.527g/cm³ |
| Ponto de fusão | 338°C (640°F) |
| Ponto de ebulição | 520°C (968°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 29,7g/100ml (25°C) |
| Solubilidade | Solúvel em etanol e acetona |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| PKa | 9h25 |
| pH | 4,6 (solução a 5%) |
Segurança e perigos do cloreto de amônio
O cloreto de amônio (NH4Cl) é geralmente considerado seguro para uso normal. No entanto, pode ser prejudicial se ingerido ou inalado em grandes quantidades. A ingestão de NH4Cl pode causar irritação na boca e garganta, náuseas, vômitos e diarreia. A inalação de NH4Cl pode causar irritação do sistema respiratório, tosse e falta de ar. NH4Cl deve ser manuseado com cuidado, pois pode causar irritação na pele e nos olhos. Também é importante evitar a exposição ao pó ou vapor de NH4Cl, que pode ser irritante para os olhos, nariz e garganta. Equipamentos de proteção individual adequados, como luvas e óculos de proteção, devem ser usados ao manusear NH4Cl.
| Símbolos de perigo | XI |
| Descrição de segurança | S22, S24/25, S36/37/39 |
| Números de identificação da ONU | ONU 3077 |
| Código SH | 2827.10.00 |
| Classe de perigo | 9 – Mercadorias perigosas diversas |
| Grupo de embalagem | III |
| Toxicidade | Baixa toxicidade, mas pode ser prejudicial se ingerido ou inalado em grandes quantidades. |
Métodos para a síntese de cloreto de amônio
O cloreto de amônio (NH4Cl) pode ser sintetizado por vários métodos.
- Um método comum é reagir o gás amônia com ácido clorídrico em água. Esta reação exotérmica produz NH4Cl na forma de um sólido cristalino branco. É importante adicionar o ácido clorídrico à água lentamente, mexendo para evitar respingos com o calor gerado.
- Outro método de produção de NH4Cl é como subproduto de vários processos industriais, como a produção de carbonato de sódio ou o processo Solvay.
- Outra forma de sintetizar NH4Cl é reagir a amônia com cloreto de sódio. Esta reação produz NH4Cl e hidróxido de sódio. Esta reação é exotérmica e requer controle cuidadoso para evitar a formação de subprodutos indesejados.
Usos do cloreto de amônio
O cloreto de amônio (NH4Cl) tem muitos usos em diferentes indústrias.
- NH4Cl serve como fertilizante na agricultura, fornecendo nutrientes essenciais às culturas, como nitrogênio e cloreto, melhorando assim o rendimento e a qualidade.
- O cloreto de amônio facilita o bom funcionamento das células secas, conduzindo eletricidade como eletrólito.
- A indústria têxtil utiliza NH4Cl como agente de tingimento e impressão, que ajuda a fixar corantes em tecidos e melhorar a solidez da cor.
- Como fluxo na metalurgia e na soldagem, o NH4Cl remove as camadas de óxido dos metais, facilitando a soldagem.
- O produto químico tem aplicações em alimentos, produtos farmacêuticos e cosméticos como agente aromatizante, expectorante em remédios para tosse e ingrediente em produtos de higiene pessoal.
No geral, as propriedades únicas do NH4Cl tornam-no um produto químico versátil com muitas aplicações importantes em diferentes indústrias.
Questões:
P: O cloreto de amônio é sublime?
R: Sim, sabe-se que o cloreto de amônio sublima, o que significa que pode passar diretamente da fase sólida para a fase gasosa sem derreter entre elas.
P: O NH4Cl é ácido ou básico?
R: O cloreto de amônio é um sal ácido. Quando dissolvido em água, pode sofrer hidrólise para produzir uma solução ácida. Isso ocorre porque o íon amônio atua como um ácido fraco e doa um próton (H+) às moléculas de água.
P: Qual é a fórmula do cloreto de amônio?
R: A fórmula do cloreto de amônio é NH4Cl. É composto por um íon amônio (NH4+) e um íon cloreto (Cl-) mantidos juntos por ligações iônicas.
P: O cloreto de amônio se dissolve na água?
R: Sim, o cloreto de amônio é altamente solúvel em água. À temperatura ambiente, aproximadamente 29,7 gramas de cloreto de amônio podem ser dissolvidos em 100 mililitros de água.
P: Como separar o cloreto de amônio e o cloreto de sódio?
R: Uma maneira de separar o cloreto de amônio e o cloreto de sódio é a sublimação. Isto pode ser conseguido aquecendo a mistura, fazendo com que o cloreto de amônio sublime enquanto o cloreto de sódio permanece na forma sólida. O cloreto de amônio sublimado pode então ser coletado e recondensado em uma forma sólida. Outro método é dissolver a mistura em água e depois precipitar seletivamente um dos sais usando um reagente específico ou ajuste de pH.
