Cloreto de alumínio ou AlCl3 é um composto químico utilizado em diversos processos industriais. Atua como um ácido de Lewis, catalisando reações de síntese orgânica e polimerização. Também possui propriedades antitranspirantes em produtos de higiene pessoal.
| Nome IUPAC | Tricloreto de alumínio |
| Fórmula molecular | AlCl3 |
| Número CAS | 7446-70-0 |
| Sinônimos | Tricloreto de alumínio, cloreto de alumínio (III), cloreto de alumínio (III), cloreto de alumínio, tricloroalumínio |
| InChI | InChI=1S/3ClH.Al/h3*1H;/q;;;+3/p-3 |
Fórmula de cloreto de alumínio
A fórmula química do cloreto de alumínio é AlCl3. Esta fórmula representa o número de átomos de cada elemento na molécula. A fórmula do cloreto de alumínio é importante porque é utilizada para identificar a substância e calcular suas propriedades. A fórmula também é usada em equações químicas para representar os reagentes e produtos de uma reação química.
Massa molar de cloreto de alumínio
O cloreto de alumínio tem massa molar de 133,34 g/mol. Este valor é calculado somando a massa atômica de um átomo de alumínio e três átomos de cloro. A fórmula molecular do cloreto de alumínio é AlCl3, o que significa que contém um átomo de alumínio e três átomos de cloro. A massa molar é uma propriedade importante do cloreto de alumínio porque é usada em muitas reações químicas e processos industriais. A massa molar também é usada para calcular a quantidade de uma substância presente em uma determinada amostra.
Ponto de ebulição do cloreto de alumínio
O ponto de ebulição do cloreto de alumínio é 180,8°C (357,4°F). Este valor é a temperatura na qual a forma líquida do cloreto de alumínio muda para o estado gasoso. O ponto de ebulição do cloreto de alumínio é relativamente alto, tornando-o útil em muitos processos industriais que requerem altas temperaturas. Por exemplo, o cloreto de alumínio é utilizado como catalisador na fabricação de polipropileno, um polímero termoplástico.
Ponto de fusão do cloreto de alumínio
O ponto de fusão do cloreto de alumínio é 194°C (381,2°F). Este valor é a temperatura na qual a forma sólida do cloreto de alumínio muda para o estado líquido. O ponto de fusão do cloreto de alumínio é relativamente baixo, o que significa que pode ser facilmente derretido e utilizado em diversas reações químicas e processos industriais. Por exemplo, o cloreto de alumínio é utilizado como coagulante na indústria de tratamento de água.
Densidade de cloreto de alumínio g/ml
A densidade do cloreto de alumínio é 2,44 g/cm3. Este valor é a massa de cloreto de alumínio por unidade de volume. A densidade do cloreto de alumínio é importante porque determina a massa de um determinado volume da substância. A densidade do cloreto de alumínio também é usada para calcular a concentração da substância em uma solução.
Estrutura de cloreto de alumínio
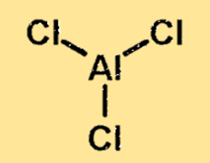
A estrutura do cloreto de alumínio é uma molécula ligada covalentemente com um átomo de alumínio e três átomos de cloro. O átomo de alumínio está localizado no centro da molécula, rodeado pelos três átomos de cloro. A estrutura do cloreto de alumínio é importante porque determina as propriedades físicas e químicas da substância.
Peso molecular do cloreto de alumínio
O peso molecular do cloreto de alumínio é 133,34 g/mol. Este valor é a soma dos pesos atômicos dos átomos da molécula. O peso molecular do cloreto de alumínio é importante porque é usado para calcular a quantidade de uma substância presente em uma determinada amostra. Este valor também é usado para determinar a concentração molar de uma solução.
| Aparência | Sólido ou pó branco a amarelo |
| Gravidade Específica | 2,44g/cm3 |
| Cor | Incolor a amarelo pálido |
| Cheiro | Inodoro |
| Massa molar | 133,34 g/mol |
| Densidade | 2,44g/cm3 |
| Ponto de fusão | 194°C (381,2°F) |
| Ponto de ebulição | 180,8°C (357,4°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel em água |
| Solubilidade | Solúvel em etanol, metanol e éter |
| Pressão de vapor | 2,67kPa a 25°C |
| Densidade do vapor | 4,45 (ar = 1) |
| pKa | -6 |
| pH | 2,0 (10 g/L, H2O) |
Segurança e perigos do cloreto de alumínio
O cloreto de alumínio apresenta vários riscos à segurança e à saúde. É corrosivo e pode causar irritação grave na pele e nos olhos, bem como irritação no trato respiratório e digestivo se ingerido ou inalado. Também pode causar queimaduras se entrar em contato com a pele. O cloreto de alumínio é um forte agente oxidante e pode reagir violentamente com a água, liberando gás cloreto de hidrogênio. Também é incompatível com muitos compostos orgânicos, como álcoois e aminas, e pode reagir com eles para produzir gases perigosos. Equipamento de proteção adequado, incluindo luvas, óculos de proteção e respirador, deve ser usado ao manusear cloreto de alumínio.
| Símbolos de perigo | Corrosivo, prejudicial |
| Descrição de segurança | Evitar o contato com a pele e os olhos. Use luvas de proteção e proteção para os olhos/face. Em caso de contato, enxaguar com água abundante e consultar um médico. Não ingerir ou inalar. Usar em uma área bem ventilada. Armazenar em local fresco e seco, longe de materiais incompatíveis. |
| Números de identificação da ONU | ONU 1726 |
| Código SH | 2827.32.00 |
| Classe de perigo | 8 |
| Grupo de embalagem | III |
| Toxicidade | Tóxico se ingerido ou inalado. Causa irritação grave na pele e nos olhos. Pode causar irritação do trato respiratório e digestivo. Pode reagir violentamente com a água, liberando gás cloreto de hidrogênio. Incompatível com muitos compostos orgânicos, como álcoois e aminas, e pode reagir com eles para produzir gases perigosos. |
Métodos para a síntese de cloreto de alumínio
O cloreto de alumínio pode ser sintetizado por vários métodos, como síntese direta, hidrólise e reação do alumínio com cloreto de hidrogênio.
- A síntese direta envolve a reação do alumínio com cloro gasoso a altas temperaturas, geralmente em torno de 700-800°C. A reação do alumínio com cloreto de hidrogênio gera cloreto de alumínio na fase gasosa, que pode ser condensado na forma líquida.
- A hidrólise envolve a reação do alumínio metálico com ácido clorídrico ou água, que produz gás hidrogênio e cloreto de alumínio. A reação de hidrólise é geralmente exotérmica e pode ser perigosa se não for realizada corretamente.
- A reação do alumínio com gás cloreto de hidrogênio é outro método de síntese de cloreto de alumínio. Esta reação ocorre à temperatura ambiente e produz gás hidrogênio e cloreto de alumínio.
- Outro método comum de síntese de cloreto de alumínio é reagir o óxido de alumínio com ácido clorídrico. Esta reação produz cloreto de alumínio e água como produtos.
- A reação do alumínio com uma mistura de cloro gasoso e monóxido de carbono é outro método de síntese de cloreto de alumínio. Esta reação ocorre em altas temperaturas e produz cloreto de alumínio e dióxido de carbono.
No geral, a síntese de cloreto de alumínio requer manuseio cuidadoso e controle das condições de reação para garantir um processo seguro e eficiente.
Usos do cloreto de alumínio
O cloreto de alumínio tem muitos usos em diversas indústrias devido às suas propriedades únicas.
- As reações químicas orgânicas, incluindo a produção de polímeros, produtos farmacêuticos e perfumes, geralmente usam cloreto de alumínio como catalisador.
- O tratamento de água potável e águas residuais para remover sólidos em suspensão envolve frequentemente o uso de cloreto de alumínio como coagulante.
- A produção de alumínio e ligas se beneficia do uso de cloreto de alumínio como fundente, que ajuda a remover impurezas e melhorar o processo de fundição.
- Na indústria petroquímica, o cloreto de alumínio serve como catalisador na produção de gasolina e outros hidrocarbonetos. Além disso, é utilizado como desodorante e antitranspirante em produtos de higiene pessoal.
- Alguns medicamentos vendidos sem receita médica usam cloreto de alumínio, que tem propriedades adstringentes, para tratar pequenas irritações da pele e estancar sangramentos. O cloreto de alumínio também é usado no tratamento da hiperidrose, uma condição caracterizada pela transpiração excessiva.
- A indústria têxtil utiliza o cloreto de alumínio como mordente para auxiliar na fixação de corantes aos tecidos, sendo também utilizado na produção de borracha sintética.
No geral, o cloreto de alumínio encontra utilizações diversas e importantes em muitas indústrias, destacando a sua importância no mundo moderno.
Questões:
P: O que melhor compara 1 mol de cloreto de sódio a 1 mol de cloreto de alumínio?
R: 1 mol de cloreto de sódio (NaCl) e 1 mol de cloreto de alumínio (AlCl3) contêm 1 mol de íons cloreto, mas o cloreto de alumínio contém três vezes mais cátions do que o cloreto de sódio.
P: O cloreto de alumínio é aquoso?
R: O cloreto de alumínio pode existir nas formas sólida e aquosa. Quando dissolvido em água, forma uma solução muito ácida devido à hidrólise do cátion alumínio.
P: Qual é a fórmula correta para o cloreto de alumínio?
R: A fórmula correta para cloreto de alumínio é AlCl3. Isto indica que cada molécula de cloreto de alumínio contém um cátion alumínio (Al3+) e três ânions cloreto (Cl-).
P: O cloreto de alumínio é seguro?
R: O cloreto de alumínio pode ser perigoso se não for manuseado corretamente. Pode causar irritação na pele e nos olhos, irritação no trato respiratório e digestivo e pode ser tóxico se ingerido ou inalado. Deve ser armazenado e manuseado em área bem ventilada e com equipamento de proteção adequado.
P: Quantos íons cloreto existem em 1,50 moles de cloreto de alumínio?
R: Como a fórmula do cloreto de alumínio é AlCl3, cada molécula contém três íons cloreto. Portanto, 1,50 moles de cloreto de alumínio contêm 1,50 x 3 = 4,50 moles de íons cloreto.
