Cloreto cuproso ou cloreto de cobre (I) é um composto com fórmula química CuCl, composto por um átomo de cobre e um átomo de cloro. É um sólido branco com estrutura cristalina e é utilizado em diversas aplicações industriais, como catalisador e na produção de outros compostos de cobre.
| Nome IUPAC | Cloreto de cobre (I) |
| Fórmula molecular | CuCl |
| Número CAS | 7758-89-6 |
| Sinônimos | Monocloreto cuproso, cloreto de cobre (CuCl), cloreto de cobre (I), cloreto cúprico, nantokita |
| InChI | InChI=1S/ClH.Cu/h1H;/q;+1/p-1 |
Fórmula de cloreto de cobre (I)
A fórmula do cloreto de cobre (I) é CuCl. Isso indica que cada molécula de cloreto de cobre (I) contém um átomo de cobre e um átomo de cloro. A fórmula pode ser usada para calcular a massa de uma amostra de cloreto de cobre(I) ou o número de moles de cloreto de cobre(I) presentes em uma amostra. A fórmula também fornece informações sobre o número relativo de átomos presentes no composto, o que é útil para a compreensão de suas propriedades e comportamento.
Massa molar de cloreto de cobre (I)
A massa molar do cloreto de cobre (I) é a massa de um mol do composto. É calculado somando as massas atômicas dos elementos que compõem o composto. O cloreto de cobre (I) tem massa molar de 98,99 g/mol. Este valor pode ser usado para converter entre a massa de uma amostra de cloreto de cobre(I) e o número de moles presentes na amostra.
Ponto de ebulição do cloreto de cobre (I)
O ponto de ebulição do cloreto de cobre (I) é a temperatura na qual o composto muda de líquido para gás. O cloreto de cobre (I) tem um ponto de ebulição relativamente baixo de 1.490°C. Isto se deve às fracas forças intermoleculares entre as moléculas de cloreto de cobre (I). A esta temperatura, as moléculas ganham energia cinética suficiente para superar as forças atrativas que as mantêm unidas na forma líquida.
Ponto de fusão do cloreto de cobre (I)
O ponto de fusão do cloreto de cobre (I) é a temperatura na qual o composto muda de sólido para líquido. O cloreto de cobre (I) tem um ponto de fusão relativamente alto de 430°C. Isto se deve às fortes ligações iônicas entre os átomos de cobre e cloro que constituem o composto. A esta temperatura, a energia térmica fornecida ao composto é suficiente para quebrar as ligações iônicas e permitir que os átomos se movam livremente na forma líquida.
Densidade do cloreto de cobre (I) g/ml
A densidade do cloreto de cobre (I) é uma medida de sua massa por unidade de volume. O cloreto de cobre (I) tem uma densidade de 4,14 g/mL à temperatura ambiente. Este valor indica que o cloreto de cobre (I) é uma substância densa e fluirá em líquidos menos densos do que ele.
Peso molecular do cloreto de cobre (I)
O peso molecular do cloreto de cobre (I) é a soma dos pesos atômicos dos átomos em uma única molécula do composto. O cloreto de cobre (I) tem peso molecular de 98,99 g/mol. Este valor pode ser usado para converter entre a massa de uma amostra de cloreto de cobre(I) e o número de moléculas presentes na amostra.
Estrutura do cloreto de cobre (I)
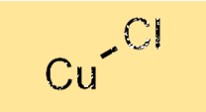
O cloreto de cobre (I) tem uma estrutura cristalina na qual os átomos de cobre são rodeados por quatro átomos de cloro em um arranjo tetraédrico. Os átomos de cobre estão ligados aos átomos de cloro por ligações iônicas, que resultam da transferência de elétrons dos átomos de cobre para os átomos de cloro. Essa estrutura confere ao cloreto de cobre (I) suas propriedades características, como alto ponto de fusão e densidade.
| Aparência | Pó cristalino branco |
| Gravidade Específica | 4,14g/cm³ |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 98,99 g/mol |
| Densidade | 4,14g/cm³ |
| Ponto de fusão | 430ºC |
| Ponto de ebulição | 1490°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 0,0095 g/L a 20°C |
| Solubilidade | Solúvel em ácido clorídrico concentrado, amônia e cianeto de potássio. Insolúvel em etanol e éter. |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | 4,6 – 5,8 (solução a 1%) |
Segurança e perigos do cloreto cuproso
O cloreto cuproso apresenta vários riscos à segurança e à saúde. É prejudicial se ingerido e pode causar irritação nos olhos, pele e sistema respiratório. O cloreto cuproso também pode causar febre dos fumos metálicos, uma condição caracterizada por sintomas semelhantes aos da gripe, como febre, calafrios e tosse. A exposição prolongada ao cloreto cuproso pode causar danos pulmonares e outros efeitos crônicos à saúde. Ao manusear cloreto cuproso, é importante usar roupas de proteção, luvas e proteção para os olhos para minimizar o risco de exposição. Em caso de ingestão ou exposição acidental, procure imediatamente atendimento médico. O manuseio, armazenamento e descarte adequados do cloreto cuproso são necessários para evitar a contaminação ambiental e danos à saúde humana.
| Símbolos de perigo | Caveira e ossos cruzados |
| Descrição de segurança | Não ingira. Use roupas de proteção, luvas e proteção para os olhos. Se ingerido ou exposto, procure atendimento médico imediatamente. É necessário manuseio, armazenamento e descarte adequados. |
| Números de identificação da ONU | ONU 3077 |
| Código SH | 28273910 |
| Classe de perigo | 6.1 |
| Grupo de embalagem | II |
| Toxicidade | Tóxico se ingerido ou inalado. Causa irritação na pele e nos olhos. Pode causar danos pulmonares e outros efeitos crônicos à saúde. |
Métodos para a síntese de cloreto cuproso
Existem vários métodos para sintetizar cloreto cuproso:
Um método comum envolve a reação entre cobre e ácido clorídrico. O cobre metálico reage com o ácido clorídrico para produzir CuCl e gás hidrogênio. CuCl pode ser purificado por filtração e secagem.
Outro método envolve a reação entre óxido de cobre e ácido clorídrico.
Para sintetizar o cloreto cuproso, o óxido de cobre pode ser adicionado a uma solução de ácido clorídrico para produzir CuCl2. Depois disso, pode-se usar um agente redutor como ácido clorídrico ou dióxido de enxofre para reduzir o CuCl2 para formar CuCl.
Outro método para sintetizar CuCl envolve dissolver sulfato de cobre e cloreto de sódio em água, aquecer a solução resultante e filtrá-la para remover impurezas. Após filtrar a solução obtida, é possível resfriá-la para formar cristais de CuCl.
Uma variação deste método envolve a reação entre sulfato de cobre e cloreto de sódio na presença de agentes redutores como ácido ascórbico ou glicose. O agente redutor reduz os íons Cu2+ no sulfato de cobre a íons Cu+, que então reagem com os íons cloreto no cloreto de sódio para formar CuCl.
No geral, esses métodos oferecem uma gama de opções para a síntese de cloreto cuproso, com variações dependendo das matérias-primas e das condições utilizadas. É necessária muita atenção às considerações ambientais e de segurança ao sintetizar e manusear cloreto cuproso.
Usos do cloreto cuproso
O cloreto cuproso tem diversas aplicações em diversos campos. Aqui estão alguns usos comuns do cloreto cuproso:
- Catálise: Utilizado como catalisador em diversas reações químicas, incluindo a síntese de compostos orgânicos como farmacêuticos e agroquímicos.
- Pigmento: Utilizado como pigmento nas indústrias de cerâmica e vidro. Dá uma cor verde aos produtos.
- Agente Antiincrustante: Usado como agente antiincrustante em aplicações marítimas para prevenir o crescimento de cracas, algas e outros organismos marinhos em navios e barcos.
- Fotografia: Usado como revelador fotográfico para produzir imagens em preto e branco. É usado como agente redutor para converter íons de prata em prata metálica.
- Galvanoplastia: usada em galvanoplastia para depositar uma camada de cobre sobre um substrato. É utilizado na fabricação de componentes eletrônicos, joias e outros produtos.
- Fungicida: Usado como fungicida para proteger as plantas de doenças fúngicas.
- Soldagem: Usado em soldagem para remover camadas de óxido de superfícies metálicas antes da soldagem.
- Gravura: Utilizado como agente de corrosão na produção de placas de circuito impresso e outros componentes eletrônicos.
O cloreto cuproso é amplamente utilizado em diversas indústrias devido às suas propriedades distintas. As indústrias o utilizam em diversas aplicações, desde catálise até revestimentos marítimos.
Questões:
P: O CuCl é solúvel em água?
R: Sim, o CuCl é ligeiramente solúvel em água, com solubilidade de aproximadamente 0,67 g/L à temperatura ambiente.
P: O CuCl é solúvel?
R: CuCl é ligeiramente solúvel em água, mas insolúvel em solventes orgânicos como etanol e éter.
P: Qual é o nome de CuCl?
R: O nome de CuCl é cloreto cuproso.
P: O que causa as bolhas quando o alumínio é colocado em uma solução de CuCl? R: Quando o alumínio é colocado em uma solução de CuCl, ocorre uma reação redox, onde o alumínio reduz os íons Cu2+ em CuCl a íons Cu+, formando cloreto de alumínio (AlCl3) e cobre metálico (Cu). As bolhas observadas são gás hidrogênio (H2) produzido como subproduto da reação entre as moléculas de alumínio e água presentes na solução.
