O clorato de sódio é um composto químico com a fórmula NaClO3. É um poderoso agente oxidante comumente utilizado na produção de fósforos, corantes e herbicidas.
| Nome IUPAC | Clorato de sódio |
| Fórmula molecular | NaClO3 |
| Número CAS | 7775-09-9 |
| Sinônimos | Ácido clórico, sal de sódio; Naclo3; Ácido clórico, sal de sódio (1:1); ONU1495; Clorato de sódio; Cloreto de Sódio; |
| InChI | InChI=1S/ClHO3.Na/c2-1(3)4;/h(H,2,3,4);/q;+1/p-1 |
Propriedades do clorato de sódio
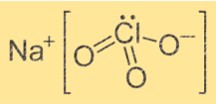
Fórmula de Clorato de Sódio
A fórmula química do clorato de sódio é NaClO3. É um composto iônico composto por um íon Na+ e um íon ClO3-. O íon Na+ tem carga positiva, enquanto o íon ClO3- tem carga negativa. A fórmula indica que um íon Na+ é combinado com um íon ClO3- para formar o composto.
Massa molar de cloreto de sódio
A massa molar do NaClO3 é 106,44 g/mol. Esta é a massa de um mol do composto, que contém o número de moléculas de Avogadro (6,022 x 10 ^ 23). É calculado somando as massas atômicas de todos os átomos do composto.
Ponto de ebulição do clorato de sódio
O ponto de ebulição do NaClO3 é 300°C (572°F). Esta é a temperatura na qual o composto muda de líquido para gasoso. O ponto de ebulição é determinado pela força das forças intermoleculares entre as moléculas.
Ponto de fusão do clorato de sódio
O ponto de fusão do NaClO3 é 248°C (478°F). Esta é a temperatura na qual o composto muda do estado sólido para o estado líquido. O ponto de fusão é determinado pela força das forças intermoleculares entre as moléculas.
Densidade de clorato de sódio g/mL
A densidade do NaClO3 é 2,49 g/mL. É a massa do composto por unidade de volume. A densidade é determinada pela massa e volume da substância.
Peso Molecular do Clorato de Sódio
O peso molecular do NaClO3 é 106,44 g/mol. É a soma dos pesos atômicos de todos os átomos do composto.
Estrutura do clorato de sódio
A estrutura do NaClO3 é cristalina. O íon Na+ é cercado por seis átomos de oxigênio de seis íons ClO3- diferentes. Os íons ClO3- formam uma forma tetraédrica ao redor do íon Na+. A estrutura é mantida unida por ligações iônicas entre o íon Na+ e os íons ClO3-.
Solubilidade do clorato de sódio
O NaClO3 é solúvel em água, etanol e metanol. Dissolve-se facilmente em água para formar uma solução límpida e incolor. A solubilidade do NaClO3 em água aumenta com a temperatura. A 20°C, a solubilidade é de 85 g/100 mL de água.
| Aparência | Sólido branco |
| Gravidade Específica | 2,49g/cm³ |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 106,44 g/mol |
| Densidade | 2,49g/ml |
| Ponto de fusão | 248°C (478°F) |
| Ponto de ebulição | 300°C (572°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 85g/100ml |
| Solubilidade | Solúvel em água, etanol e metanol |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Neutro (7) |
Segurança e perigos do clorato de sódio
O NaClO3 é um forte agente oxidante e deve ser manuseado com cuidado. Existe um risco potencial de incêndio e explosão quando entra em contato com materiais orgânicos como papel, madeira ou óleo. Também pode reagir violentamente com agentes redutores, ácidos e pós metálicos. A ingestão ou inalação de NaClO3 pode causar efeitos graves à saúde, como problemas respiratórios, dores abdominais e vômitos. O NaClO3 também pode irritar a pele, os olhos e o sistema respiratório. Equipamento de proteção adequado, incluindo luvas, óculos de proteção e respirador, deve ser usado ao trabalhar com NaClO3 para evitar exposição e riscos potenciais.
| Símbolos de perigo | Agente oxidante |
| Descrição de segurança | Nocivo se ingerido, causa irritação ocular grave, pode causar irritação do trato respiratório |
| Números de identificação da ONU | ONU 1495 |
| Código SH | 2829.19.00 |
| Classe de perigo | 5.1 (Materiais oxidantes) |
| Grupo de embalagem | II |
| Toxicidade | Tóxico por ingestão ou inalação, irritante para a pele e os olhos |
Métodos para a síntese de clorato de sódio
Existem vários métodos para sintetizar NaClO3.
Um método comum é eletrolisar uma solução de cloreto de sódio . Isso envolve a passagem de uma corrente elétrica pela solução, o que faz com que o cloreto de sódio se decomponha em NaClO3 e cloro gasoso. Outro método envolve a reação de hidróxido de sódio com cloro gasoso para formar NaClO3 e cloreto de sódio.
Um terceiro método envolve a reação de carbonato de sódio com cloro gasoso na presença de um catalisador. Isto produz NaClO3, cloreto de sódio e dióxido de carbono. A reação entre hipoclorito de sódio e hidróxido de sódio pode produzir NaClO3 como alternativa. Esta reação resulta na formação de NaClO3, cloreto de sódio e água.
Além desses métodos, o NaClO3 também pode ser produzido pela reação do clorito de sódio com peróxido de hidrogênio. Esta reação resulta na formação de NaClO3, água e oxigênio gasoso.
Usos do clorato de sódio
O NaClO3 tem vários usos em diversas indústrias. Alguns de seus usos comuns incluem:
- Herbicida: Amplamente utilizado como herbicida, especialmente para controlar ervas daninhas em áreas não cultivadas, como beiras de estradas, linhas ferroviárias e linhas de energia. Ao interromper a fotossíntese das plantas, pode controlar eficazmente várias ervas daninhas.
- Alvejante: Utilizado na indústria de celulose e papel como agente branqueador. É particularmente eficaz na produção de papel branco brilhante de alta qualidade.
- Mineração: Utilizado na indústria de mineração como agente oxidante para extração de ouro e outros metais preciosos.
- Explosivos: Utilizados como ingrediente na fabricação de explosivos como dinamite e clorato de amônio.
- Corantes e pigmentos: Utilizados na produção de corantes e pigmentos, principalmente para colorir têxteis.
- Laboratório: Utilizado em laboratório como reagente para diversas reações químicas.
- Tratamento de Água: Utilizado no tratamento de água para controlar o crescimento de algas e como desinfetante.
- Conservante de alimentos: Também usado como conservante de alimentos para prolongar a vida útil de certos alimentos.
Questões:
P: Como fazer clorato de sódio?
R: O NaClO3 pode ser fabricado por vários métodos, como eletrólise de solução de cloreto de sódio, reação de hidróxido de sódio com cloro gasoso e reação de carbonato de sódio com cloro gasoso na presença de um catalisador.
P: Quanto tempo leva o clorato de sódio para matar as ervas daninhas?
R: O NaClO3 é um herbicida poderoso e pode matar ervas daninhas poucos dias após a aplicação. O tempo necessário para matar as ervas daninhas pode variar dependendo de fatores como a concentração de NaClO3 utilizada e o tipo de erva daninha alvo.
P: O clorato de sódio é uma substância pura?
R: Sim, o NaClO3 é uma substância pura porque é um composto composto apenas por átomos de sódio, cloro e oxigênio.
P: O clorato de sódio é solúvel em água?
R: Sim, o NaClO3 é altamente solúvel em água. Pode dissolver-se em água para formar uma solução límpida e incolor.
P: Quantos átomos de oxigênio existem em uma molécula de clorato de sódio?
R: Uma molécula de NaClO3 possui três átomos de oxigênio. Sua fórmula química é NaClO3.
P: O clorato de sódio é iônico ou covalente?
R: NaClO3 é um composto iônico. É formado pela transferência de elétrons dos átomos de sódio para os átomos de cloro para formar íons Na+ carregados positivamente e íons NaClO3 carregados negativamente.
