O clorato de potássio (KClO3) é um composto químico composto de potássio, cloro e oxigênio. É comumente utilizado na fabricação de fósforos, explosivos e fogos de artifício devido às suas propriedades oxidantes.
| Nome IUPAC | Cloreto de Potássio |
| Fórmula molecular | KClO3 |
| Número CAS | 3811-04-9 |
| Sinônimos | Clorato de potássio, Clorcálico, Clorato de potássio, Perclorato de potássio, ONU 1485, Clorato de potássio, Perclorato de potássio |
| InChI | InChI=1S/ClH3KO3/c2-1(3)4/h(H3,2,3,4)/p-1 |
Propriedades do clorato de potássio
Fórmula de Clorato de Potássio
O clorato de potássio tem fórmula química KClO3, o que indica que é composto por um átomo de potássio, um átomo de cloro e três átomos de oxigênio. É um composto iônico que se forma quando os íons K+ e ClO3- se combinam por meio de uma ligação iônica. O composto é muito reativo devido à presença de oxigênio, conferindo-lhe fortes propriedades oxidantes.
Massa molar de Clorato de Potássio
A massa molar do KClO3 é 122,55 g/mol. É a soma das massas atômicas dos elementos individuais que constituem o composto, nomeadamente potássio, cloro e oxigênio. A massa molar é um parâmetro importante em química porque é usada para calcular a massa de uma substância necessária para produzir uma certa quantidade de produto em uma reação química.
Ponto de ebulição do clorato de potássio
O KClO3 não possui ponto de ebulição bem definido, pois se decompõe antes de atingir seu ponto de ebulição. Quando aquecido, decompõe-se em cloreto de potássio e gás oxigênio. Portanto, o KClO3 sofre uma reação de decomposição térmica em vez de um ponto de ebulição.
Clorato de potássio Ponto de fusão
O ponto de fusão do KClO3 é 356°C (673°F). A esta temperatura, o composto sólido derrete e se transforma em líquido. O ponto de fusão é uma propriedade essencial de um composto porque influencia o comportamento físico da substância, incluindo a sua solubilidade e densidade.
Densidade de clorato de potássio g/mL
A densidade do KClO3 é 2,32 g/mL à temperatura ambiente. Isso significa que um volume específico do composto possui uma certa massa, o que é útil para determinar a massa de uma substância necessária para uma determinada reação química. A densidade do KClO3 também afeta sua solubilidade em água, pois compostos com maior densidade tendem a ser menos solúveis em água.
Peso Molecular do Clorato de Potássio
O peso molecular do KClO3 é 122,55 g/mol. É a soma dos pesos atômicos dos seus átomos constituintes, nomeadamente potássio, cloro e oxigênio. O peso molecular é um parâmetro essencial na estequiometria porque é usado para calcular as quantidades de reagentes e produtos em uma reação química.
Estrutura do Clorato de Potássio
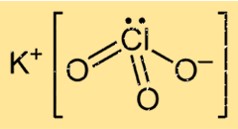
O KClO3 possui uma estrutura cristalina em sua forma sólida, composta por átomos de potássio, cloro e oxigênio dispostos em um padrão específico. O composto forma uma estrutura cristalina cúbica de face centrada, na qual cada íon de potássio é circundado por seis átomos de oxigênio e cada íon de oxigênio é circundado por quatro átomos de potássio e dois átomos de cloro.
Solubilidade do clorato de potássio
KClO3 é moderadamente solúvel em água, com solubilidade de 7 g/100 ml de água à temperatura ambiente. A solubilidade do composto aumenta com a temperatura, porque as moléculas de água têm mais energia cinética e podem dissolver mais do composto. KClO3 também é solúvel em outros solventes polares, como etanol e acetona.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 2,32g/cm³ |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 122,55 g/mol |
| Densidade | 2,32g/cm³ |
| Ponto de fusão | 356°C (673°F) |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 7 g/100 mL a 20°C |
| Solubilidade | Solúvel em etanol e acetona |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | 1,8 (Ka = 1,6 × 10⁻⁵) |
| pH | O pH de uma solução 0,1 M é aproximadamente 6,5 a 7,5 |
Segurança e perigos do clorato de potássio
O KClO3 é uma substância altamente reativa e potencialmente perigosa, por isso deve ser manuseado com extremo cuidado. Pode causar irritação grave na pele e nos olhos e pode ser tóxico se ingerido ou inalado. Quando aquecido, pode reagir violentamente e até explodir. O KClO3 também pode reagir fortemente com outros produtos químicos, como ácido sulfúrico e compostos orgânicos, e produzir gases tóxicos como cloro e dióxido de clorato. É importante seguir os protocolos de segurança adequados ao trabalhar com KClO3, incluindo o uso de equipamento de proteção e o trabalho em uma área bem ventilada.
| Símbolos de perigo | Ó, Xi, N |
| Descrição de segurança | Evite o contato com materiais combustíveis. Tóxico se ingerido. Causa queimaduras na pele e lesões oculares graves. |
| Números de identificação da ONU | ONU1485 |
| Código SH | 2829.90.10 |
| Classe de perigo | 5.1 |
| Grupo de embalagem | II |
| Toxicidade | Muito tóxico |
Métodos de síntese de clorato de potássio
Existem vários métodos para sintetizar KClO3.
Um método envolve a reação entre cloreto de potássio e alvejante. Este método envolve adicionar uma solução de água sanitária a uma solução de cloreto de potássio e agitar a mistura. Para obter KClO3, filtrar e lavar o precipitado obtido.
Outro método envolve a eletrólise de uma solução contendo cloreto de potássio , água e uma fonte de oxigênio. Uma célula eletrolítica, dispositivo especializado, realiza esse processo separando íons potássio e cloreto e produzindo gás oxigênio. O oxigênio reage com íons potássio para formar KClO3.
Um terceiro método envolve a reação entre hidróxido de potássio e cloro gasoso, que produz KClO3 com cloreto de potássio e água. Este método requer um controle cuidadoso da temperatura e concentração dos reagentes para garantir rendimentos ideais.
Usos do clorato de potássio
KClO3 tem uma ampla gama de utilizações em diversas indústrias, incluindo:
- Produtos pirotécnicos: Comumente usados como agente oxidante em fogos de artifício e outros dispositivos pirotécnicos.
- Fósforos: Usados em cabeças de fósforos de segurança, que acendem quando atingidas contra uma superfície áspera.
- Fertilizante: Usado como fonte de potássio para fertilizantes vegetais.
- Alvejante: Usado como agente de branqueamento para têxteis, papel e outros materiais.
- Reagente de Laboratório: Também usado como reagente de laboratório para diversas reações químicas.
- Aplicações Médicas: Usado medicinalmente para tratar certos tipos de doenças de pele, como eczema.
- Explosivos: Ingrediente comum em alguns tipos de explosivos, como detonadores e dinamite.
- Oxidante: Usado como agente oxidante na produção de certos produtos químicos, como percloratos.
Questões:
P: Quantos gramas de cloreto de potássio são produzidos se 25g de clorato de potássio se decompõem?
R: Quando 25 g de KClO3 se decompõem, produzem 13,47 g de cloreto de potássio.
P: Como fazer clorato de potássio?
R: O KClO3 pode ser produzido pela reação do cloreto de potássio com água sanitária, pela eletrólise de uma solução contendo cloreto de potássio ou pela reação do hidróxido de potássio com cloro gasoso.
P: Quantos moles de oxigênio são produzidos quando 2 moles de clorato de potássio (kclo3) se decompõem?
R: Quando 2 moles de KClO3 se decompõem, produzem 3 moles de gás oxigênio.
Q: Uma solução de 0,70 m contém 3,0 g de clorato de potássio (kclo3). Qual é o volume da solução?
A: O volume da solução de 0,70 m contendo 3,0 g de KClO3 é 51,4 mL.
P: O clorato de potássio é volátil?
R: O KClO3 não é considerado uma substância volátil porque tem um ponto de fusão e ebulição relativamente alto.
P: Quanto kcl é produzido se você decompor 2,50 g de kclo3?
R: Quando 2,50 g de KClO3 se decompõem, produzem 1,35 g de cloreto de potássio.
P: O kclo3 é solúvel em água?
R: Sim, o KClO3 é altamente solúvel em água, com solubilidade de 7 g/100 mL à temperatura ambiente.
P: Quantos gramas de oxigênio podem ser produzidos a partir da decomposição de 100 g de kclo3?
R: Quando 100 g de KClO3 se decompõem, produzem 45,02 g de gás oxigênio.
