Clorato de cálcio (Ca(ClO3)2) é um composto químico composto de cálcio, cloro e oxigênio. É comumente usado como agente oxidante em fogos de artifício e fósforos. Também pode ser utilizado para esterilizar equipamentos na indústria alimentícia.
| Nome IUPAC | Clorato de cálcio |
| Fórmula molecular | Ca(ClO3)2 |
| Número CAS | 10137-74-3 |
| Sinônimos | Ácido clórico, sal de cálcio; Clorato de cálcio hidratado; Perclorato de cálcio; Calcioclorito; ONU1456 |
| InChI | InChI=1S/Ca.2ClHO3/c;2 2-1(3)4/h;2 (H,2,3,4)/q+2;;/p-2 |
Propriedades do clorato de cálcio
Fórmula de Clorato de Cálcio
A fórmula do clorato de cálcio é Ca(ClO3)2. É composto por um íon Ca2+ e dois íons ClO3-. O clorato de cálcio é um composto iônico, o que significa que é mantido unido pela atração eletrostática entre íons positivos e negativos.
Massa molar de clorato de cálcio
A massa molar do Ca(ClO3)2 é 206,98 g/mol. Isso pode ser calculado somando as massas atômicas de cálcio, cloro e oxigênio que compõem o composto. A massa molar é importante para calcular a quantidade de Ca(ClO3)2 necessária para uma determinada reação.
Ponto de ebulição do clorato de cálcio
Ca(ClO3)2 não tem ponto de ebulição porque se decompõe antes de atingir seu ponto de ebulição. Quando aquecido, o Ca(ClO3)2 se decompõe em cloreto de cálcio (CaCl2) e gás oxigênio (O2). Esta decomposição é exotérmica e pode ser perigosa se não for manuseada adequadamente.
Clorato de cálcio Ponto de fusão
O ponto de fusão do Ca(ClO3)2 é 135°C. Esta é a temperatura na qual o composto sólido muda de sólido para líquido. Ca(ClO3)2 é um sólido cristalino branco à temperatura e pressão ambientes.
Densidade de clorato de cálcio g/mL
A densidade do Ca(ClO3)2 é 2,4 g/mL. Isto significa que um mililitro de Ca(ClO3)2 pesa 2,4 gramas. Densidade é uma medida da densidade das moléculas em uma substância. Ca(ClO3)2 é mais denso que a água, que tem densidade de 1 g/mL.
Peso Molecular do Clorato de Cálcio
O peso molecular do Ca(ClO3)2 é 206,98 g/mol. É igual à massa molar e pode ser calculada somando os pesos atômicos dos elementos individuais do composto.
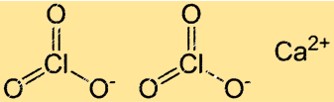
Estrutura do clorato de cálcio
Ca(ClO3)2 possui uma estrutura cristalina típica de compostos iônicos. Nesta estrutura, os íons Ca2+ e ClO3- estão dispostos em um padrão regular e repetitivo. Cada íon Ca2+ está rodeado por seis íons ClO3- e cada íon clorato está rodeado por seis íons cálcio.
Solubilidade do clorato de cálcio
Ca(ClO3)2 é solúvel em água e forma uma solução límpida e incolor. A solubilidade do Ca(ClO3)2 em água aumenta com a temperatura. No entanto, é menos solúvel em solventes orgânicos como etanol e acetona. Ca(ClO3)2 também é higroscópico, o que significa que absorve a umidade do ar. Isso pode molhar ou dissolver o composto com o tempo.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 2.4 |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 206,98 g/mol |
| Densidade | 2,4 g/ml |
| Ponto de fusão | 135ºC |
| Ponto de ebulição | Decompõe-se antes do ponto de ebulição |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Solúvel |
| Solubilidade | Solúvel em água, menos solúvel em solventes orgânicos |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Não aplicável |
Segurança e perigos do clorato de cálcio
O Ca(ClO3)2 é considerado uma substância perigosa e deve ser manuseado com cuidado. É um agente oxidante que pode reagir violentamente com materiais orgânicos, causando incêndios e explosões. A inalação ou ingestão de Ca(ClO3)2 pode causar irritação respiratória e gastrointestinal. A exposição prolongada pode causar irritação na pele, queimaduras e possíveis reações alérgicas. É importante usar equipamento de proteção individual adequado ao manusear Ca(ClO3)2, incluindo luvas, óculos de proteção e respirador. Se exposto, procure atendimento médico imediatamente. Armazene o Ca(ClO3)2 em local fresco, seco e bem ventilado, longe de substâncias incompatíveis.
| Símbolos de perigo | Ó, Xn |
| Descrição de segurança | Mantenha longe de materiais orgânicos. Use equipamento de proteção individual. Armazenar em local fresco, seco e bem ventilado. |
| Números de identificação da ONU | ONU1458 |
| Código SH | 2829.11.00 |
| Classe de perigo | 5.1 |
| Grupo de embalagem | II |
| Toxicidade | Tóxico se ingerido ou inalado. Pode causar irritação na pele e nos olhos. Pode causar irritação respiratória. |
Métodos de síntese de clorato de cálcio
Para sintetizar Ca(ClO3)2, podemos usar diferentes métodos.
Um método comum envolve a reação do hidróxido de cálcio com cloro gasoso. Neste processo, o cloreto de cálcio é primeiro formado como subproduto, que reage com o cloro restante para formar Ca(ClO3)2.
Outro método envolve a reação do carbonato de cálcio com ácido nítrico e cloro gasoso. Para obter Ca(ClO3)2, a solução obtida é evaporada e cristalizada.
Outra abordagem envolve a eletrólise de uma solução contendo cloreto de cálcio e clorato de sódio. Este processo produz Ca(ClO3)2 e cloreto de sódio como produtos finais.
A reação entre o hipoclorito de cálcio e o clorato de sódio produz Ca(ClO3)2, que é então purificado e cristalizado.
Usos do clorato de cálcio
Ca(ClO3)2 tem vários usos importantes em diversas indústrias. Aqui estão algumas das aplicações mais comuns de Ca(ClO3)2:
- Alvejante: Usado como agente de branqueamento na indústria de papel e celulose.
- Fogos de artifício: Agente oxidante comumente usado na produção de fogos de artifício.
- Fósforos: Também utilizados na produção de fósforos de segurança, pois podem ser facilmente acesos.
- Herbicidas: Usado como herbicida porque pode matar seletivamente certas ervas daninhas sem prejudicar as plantações.
- Agente oxidante: Utilizado como agente oxidante na produção de outros produtos químicos, como percloratos e cloratos.
- Produtos farmacêuticos: Também utilizados na produção de produtos farmacêuticos, como medicamentos anti-infecciosos.
- Reagente de laboratório: usado como reagente de laboratório para química analítica.
- Produção de Pigmentos: Utilizado na produção de pigmentos, como o azul ultramarino.
Questões:
P: Qual é a fórmula do clorato de cálcio?
R: A fórmula química do clorato de cálcio é Ca(ClO3)2.
P: Para que é usado o clorato de cálcio?
R: O Ca(ClO3)2 tem diversas aplicações em indústrias, como agente branqueador na indústria de papel e celulose, agente oxidante na produção de outros produtos químicos, herbicidas, pigmentos de produção e reagentes de laboratório.
P: O clorato de cálcio é um sólido?
R: Sim, Ca(ClO3)2 é um sólido à temperatura ambiente.
P: Onde o clorato de sódio é mais comumente encontrado e para que é usado o clorato de cálcio?
R: O clorato de sódio é mais comumente encontrado na indústria química, onde é usado como agente oxidante e herbicida. O Ca(ClO3)2, por outro lado, é utilizado como agente branqueador, agente oxidante e herbicida em diversas indústrias.
P: Qual é o número total de átomos no composto Ca(ClO3)2?
R: O composto Ca(ClO3)2 tem um total de 13 átomos: 1 átomo de cálcio, 2 átomos de cloro e 6 átomos de oxigênio dos dois íons ClO3-.
P: Qual é a porcentagem em massa de cloro em Ca(ClO3)2?
R: A massa atômica do cloro é 35,5 g/mol e a massa molar do Ca(ClO3)2 é 238,98 g/mol. Portanto, a porcentagem em massa de cloro em Ca(ClO3)2 é (2 x 35,5 g/mol) / 238,98 g/mol x 100% = 29,68%.
P: Quantos átomos de cloro existem no Ca(ClO3)2?
R: Existem dois átomos de cloro no Ca(ClO3)2, representados pelos dois grupos ClO3.
P: Qual é a massa de cada composto na mistura original de Ca(ClO3)2 e Ca(ClO)2?
R: É impossível determinar a massa de cada composto na mistura original sem informações adicionais, como a massa total ou a razão de massa entre os dois compostos.
